
アセチレンの構造的特徴は、その特性、生産、使用に影響します。物質の組成の記号はCです2N2 -これは、その最も単純で大まかな公式です。アセチレンは2つの炭素原子によって形成され、その間に三重結合が生じます。その存在は、エチン分子のさまざまなタイプの式とモデルに反映されており、物質の特性に対する構造の影響の問題を理解することができます。
アルキン炭化水素、またはアセチレンは非環式、不飽和。炭素原子の鎖は閉じておらず、単純で複数の結合を含んでいます。アルキンの組成は、統合された式Cを反映しています氏X2n -2. В молекулах веществ этого класса присутствует 1つ以上の三重結合。アセチレン化合物は不飽和です。これは、水素により1価の炭素のみが実現されることを意味します。残りの3つの結合は、他の炭素原子との相互作用に使用されます。
最初の-そして最も有名な代表者アルキン-アセチレン、またはエチン。物質の些細な名前は、ラテン語の「acetum」-「酢」とギリシャ語の「hyle」-「tree」に由来します。同族シリーズの創始者は1836年に化学実験で発見され、後に物質は石炭と水素からE.デービーとM.ベルトロット(1862)によって合成されました。アセチレンは、常温および大気圧では気体の状態です。それは無色のガスで、無臭で、水にほとんど溶けません。エチンはエタノールとアセトンに溶けやすい。

Etinは同族列の中で最も単純なメンバーであり、その構成と構造は次の式を反映しています。
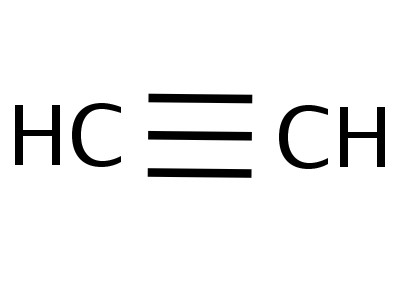
電子の分布を示す式、原子軌道モデル、分子の空間式(立体化学)を作成するための基盤として機能しました。 18世紀の終わりまで、ボールロッドモデルが普及しました。たとえば、アセチレンを形成する炭素と水素を表すさまざまな色とサイズのボールです。分子の構造式は、各原子での化学結合とその量を象徴する棒の形で表されます。
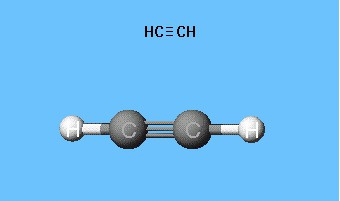
Шаростержневая модель ацетилена воспроизводит 180°の原子価角ですが、分子内の核間距離はほぼ反映されます。ボール間の空隙は、原子の空間を電子密度で満たすという考えを生み出しません。欠点は、原子核をボールではなく、ロッドの相互接続点によって指定するDradingモデルで解消されます。現代の体積モデルは、原子軌道および分子軌道のより鮮明なアイデアを提供します。
励起状態の炭素には、3つのp軌道と1組の不対電子が含まれます。メタンの形成(CH4) 同等の作成に参加します水素原子と結合します。アメリカの有名な研究者L.ポーリングは、原子軌道のハイブリッド状態(AO)のドクトリンを開発しました。化学反応における炭素の挙動の説明は、AOの形状とエネルギー、新しい雲の形成を等しくすることです。ハイブリッド軌道はより強い結合を与え、式はより安定します。
アセチレン分子の炭素原子、とは異なりメタンはspハイブリダイゼーションを受けます。形状とエネルギーでは、s-電子とp-電子が混合されています。 180度の角度で横たわり、核の反対側に向けられた2つのsp軌道が表示されます。

アセチレンでは、ハイブリッド電子炭素雲同じ隣接原子とC – Hペアの水素とのσ結合の作成に参加します。互いに垂直な2つの非ハイブリッドp軌道が残っています。エチン分子では、それらは2つのπ結合の形成に関与しています。 σとともに三重結合が発生し、構造式に反映されます。アセチレンは、原子間の距離がエタンやエチレンと異なります。三重結合は二重結合よりも短いですが、エネルギーの供給量が多く、より耐久性があります。 σおよびπ結合の最大密度は垂直領域にあり、円筒形の電子雲が形成されます。
エチン分子は線形の形状をしており、成功していますアセチレンの化学式を反映-H –C≡C– H炭素原子と水素原子は1つの直線に沿って配置され、3つのσ結合と2つのπ結合がそれらの間に生じます。自由な動き、C – C軸に沿った回転は不可能です。これは、複数の結合の存在によって防止されます。三重結合の他の特徴:
比較のために:エタンとエチレンの分子では、一重および二重の化学結合の長さはそれぞれ1.54および1.34 nmであり、CC破壊エネルギーは348 kJ / mol、C = C-614 kJ / molです。

アセチレンはアルキンの最も単純な代表であり、分子内には三重結合もあります。プロピンCH3С≡СН-アセチレンの同族体。アルキンの第3の代表の式-ブチン-1-CH3CH2С≡СН。アセチレンはエチンの一般的な名前です。アルキンの体系的な命名法は、IUPACルールに従います。

エチンとプロピンには三重位異性体がありません接続、それらはブチンで始まります。ペンチンとそれに続く同族体には、炭素骨格の異性体があります。三重結合に関しては、アセチレン炭化水素の空間異性は現れません。
エチンの最初の4つの同族体は、水に溶けにくい気体です。アセチレン炭化水素C5 -C15 -液体。固体は炭化水素Cで始まるエチン同族体です17。アルキンの化学的性質が経験しています三重結合の重要な影響。このタイプの炭化水素はエチレンよりも活性が高く、さまざまな粒子を付着させます。産業および技術におけるエチンの広範な使用は、この特性に基づいています。アセチレンを燃焼させると、大量の熱が放出され、金属のガス切断および溶接に使用されます。
