
단백질은 생물학적 고분자로서복잡한 구조. 그들은 높은 분자량을 가지고 있으며, 아미노산, 비타민, 지질 및 탄수화물 함유 물로 대표되는 보철 그룹으로 구성됩니다. 탄수화물, 비타민, 금속 또는 지질을 함유 한 단백질을 복합체라고합니다. 간단한 단백질은 펩타이드 결합으로 연결된 아미노산만으로 구성됩니다.

그것이 가지고있는 구조와 상관없이물질, 단백질 단량체는 아미노산입니다. 그들은 단백질의 원 섬유 또는 구상 구조가 형성되는 기본 폴리펩티드 사슬을 형성합니다. 동시에 단백질은 식물, 박테리아, 곰팡이, 동물 및 다른 세포에서 살아있는 조직에서만 합성 될 수 있습니다.
할 수없는 유일한 유기체단백질 단량체를 연결하기 위해 바이러스와 간단한 박테리아가 있습니다. 다른 모든 것들은 구조 단백질을 형성 할 수 있습니다. 그러나 단백질의 단량체는 어떤 물질이며 어떻게 형성됩니까? 이것과 단백질 생합성, 폴리펩티드 및 복잡한 단백질 구조, 아미노산 및 그 특성에 대해 읽으십시오.
단백질 분자의 유일한 단량체는임의의 알파 아미노산. 또한, 단백질은 연결된 아미노산의 사슬 인 폴리펩티드이다. 이의 형성에 관여하는 아미노산의 수에 따라, 디 펩티드 (2 잔기), 트리 펩티드 (3), 올리고 펩티드 (2-10 아미노산 함유) 및 폴리펩티드 (많은 아미노산)가 분리된다.
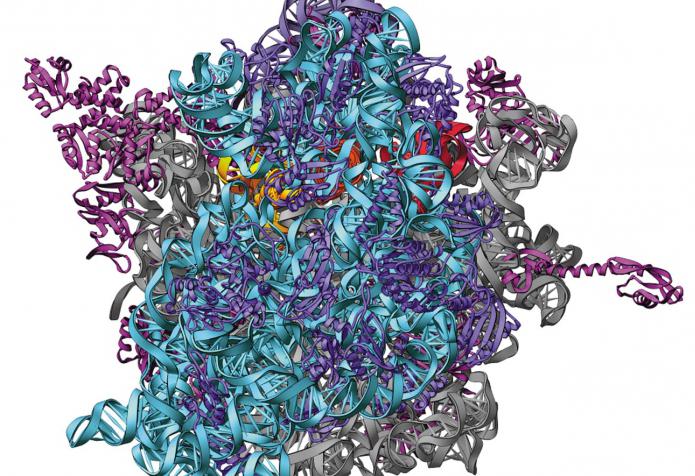
단백질 구조는 1 차, 약간 더 2 차, 훨씬 더 3 차, 가장 복잡한 4 차일 수 있습니다.
Первичная структура - это простая цепь, в которую 단백질 (아미노산)의 펩티드 결합 (CO-NH) 단량체를 통해 연결된다. 이차 구조는 알파 나선 또는 베타 폴드입니다. 3 차는 단백질의 훨씬 더 복잡한 3 차원 구조이며, 소수성 상호 작용뿐만 아니라 공유, 이온 및 수소 결합의 형성으로 인해 2 차로부터 형성되었다.
4 차 구조는 가장 복잡하고세포막에 위치한 수용체 단백질의 특성. 이것은 여러 분자를 탄수화물, 지질 또는 비타민 그룹이 보충 된 3 차 구조와 결합하여 형성된 초분자 (도메인) 구조입니다. 이 경우, 1 차, 2 차 및 3 차 구조에서와 같이, 알파-아미노산은 단백질의 단량체이다. 이들은 또한 펩티드 결합에 의해 연결된다. 유일한 차이점은 구조의 복잡성입니다.
단백질 분자의 유일한 단량체는알파 아미노산. 그들 중 20 명만이 있으며, 그들은 거의 인생의 기초입니다. 펩티드 결합의 출현으로 인해 단백질 합성이 가능 해졌다. 그 후 단백질 자체가 구조 형성, 수용체, 효소, 수송, 매개체 및 기타 기능을 수행하기 시작했습니다. 덕분에 살아있는 유기체가 기능하고 번식 할 수 있습니다.
알파 아미노산 자체는알파 탄소 원자에 결합 된 아미노기를 갖는 유기 카르 복실 산. 후자는 카르복시기 옆에 위치한다. 이 경우, 단백질 모노머는 말단 탄소 원자가 아민 및 카르복실기를 둘 다 갖는 유기 물질로 간주된다.

Аминокислоты соединяются в димеры, тримеры и 펩티드 결합을 통한 중합체. 그것은 하나의 알파 아미노산의 카르 복실 영역으로부터 하이드 록실 (-OH) 그룹 및 다른 알파 아미노산의 아미노 그룹으로부터 수소 (-H)의 절단에 의해 형성된다. 상호 작용의 결과, 물이 분리되고, 카르 복실 말단에는 카르 복실 잔기의 탄소 근처에 자유 전자를 갖는 C = O 부위가 남아있다. 다른 산의 아미노 그룹에는 질소 원자에 자유 라디칼이 존재하는 (NH) 잔기가있다. 이를 통해 두 개의 라디칼을 결합 형성 (CONH)으로 연결할 수 있습니다. 이것을 펩타이드라고합니다.

총 23 개의 알파 아미노산이 알려져 있습니다.이들은 글리신, 발린, 알라닌, 이소 신, 류신, 글루타메이트, 아스파 라기 네이트, 오르니 틴, 트레오닌, 세린, 리신, 시스틴, 시스테인, 페닐알라닌, 메티오닌, 티로신, 프롤린, 트립토판, 옥시 프롤린, 아르기닌, 아르기닌,리스트 린의 형태로 제공됩니다. 글루타민. 그것들이 인체에 의해 합성 될 수 있는지에 따라, 이들 아미노산은 교체 가능하고 대체 불가능한 것으로 나뉜다.
대신 할 수있는 인체는대신 할 수없는 것은 음식에서만 나올 수 있습니다. 동시에, 대체 할 수없는 산과 필수적이 아닌 산은 단백질 생합성에 중요하다. 이들 없이는 합성이 완료 될 수 없기 때문이다. 하나의 아미노산이 없으면 다른 모든 아미노산이 존재하더라도 세포가 기능을 수행하는 데 필요한 단백질을 정확하게 만드는 것은 불가능합니다.
생합성의 모든 단계에서 하나의 실수-및단백질은 전자 밀도 및 원 자간 상호 작용의 위반으로 인해 원하는 구조로 조립할 수 없기 때문에 이미 사용할 수 없습니다. 따라서 사람 (및 다른 유기체)은 필수 아미노산을 함유 한 단백질 제품을 섭취하는 것이 중요합니다. 음식이 없으면 단백질 대사가 여러 번 위반됩니다.
유일한 단백질 단량체는알파 아미노산. 이들은 점차 폴리펩티드 사슬로 결합되며, 그 구조는 DNA의 유전자 코드 (또는 박테리아 생합성이 고려되는 경우 RNA)에 미리 저장되어있다. 이 경우 단백질은 엄격한 아미노산 잔기 시퀀스입니다. 이것은 특정 구조로 정렬되어 셀에서 사전 프로그래밍 된 기능을 수행하는 체인입니다.
단백질 형성 과정은 일련의 단계로 구성됩니다.DNA 조각 (또는 RNA)의 복제, 정보 형 RNA의 합성, 핵으로부터 세포의 세포질로의 방출, 리보솜과의 연결 및 수송 RNA에 의해 공급되는 아미노산 잔기의 점진적인 부착. 단백질 단량체 인 물질은 히드 록 실기 및 수소 양성자의 제거에 대한 효소 반응에 참여한 후 성장하는 폴리펩티드 사슬에 합류한다.
따라서, 폴리펩티드 사슬이 얻어지고,이는 이미 세포질 소포체에서 소정의 미리 정해진 구조로 정렬되고 필요한 경우 탄수화물 또는 지질 잔기로 보충된다. 이를 단백질의 "성숙"과정이라고하며, 이후 세포 수송 시스템에 의해 목적지로 향하게됩니다.
단백질 단량체는 아미노산,기본 구조를 구축하는 데 필요합니다. 2 차, 3 차 및 4 차 구조는 이미 자체적으로 형성되지만 때로는 효소 및 기타 물질의 참여가 필요합니다. 그러나 단백질이 기능을 수행하는 데 필수적이지만 더 이상 필수는 아닙니다.
단백질 단량체 인 아미노산은탄수화물, 금속 또는 비타민에 대한 부착 점이 있습니다. 3 차 또는 4 차 구조의 형성은 삽입 그룹의 위치를위한 훨씬 더 많은 장소를 찾을 수있게한다. 이것은 단백질로부터 유도체를 생성하는 것을 가능하게하며, 효소, 수용체, 세포 내로 또는 세포로부터 물질의 운반체, 면역 글로불린, 막 또는 세포 소기관의 구조적 성분, 근육 단백질의 역할을한다.

아미노산으로 만든 단백질은인생의 유일한 기초. 그리고 오늘날 생명은 아미노산의 출현과 중합의 결과로 시작된 것으로 믿어집니다. 결국, 그것은 지적 생활을 포함하여 삶의 시작 인 단백질의 분자간 상호 작용입니다. 단백질 생합성의 구현을 위해서는 에너지를 포함한 다른 모든 생화학 적 과정이 필요하며, 그 결과 수명이 연장됩니다.
