
De structurele kenmerken van acetyleen beïnvloeden zijn eigenschappen, productie en gebruik. Het symbool voor de samenstelling van de stof is C2H2 - Dit is de eenvoudigste en bruto formule.Acetyleen wordt gevormd door twee koolstofatomen, waartussen een drievoudige binding optreedt. De aanwezigheid ervan wordt weerspiegeld in verschillende soorten formules en modellen van het ethinemolecuul, waardoor het probleem van de invloed van de structuur op de eigenschappen van een stof kan worden begrepen.
Углеводороды алкины, или ацетиленовые, являются acyclisch, onverzadigd. De keten van koolstofatomen is niet gesloten, deze bevat eenvoudige en meervoudige bindingen. De samenstelling van alkynen weerspiegelt de geconsolideerde formule CnX2n - 2. In de moleculen van stoffen van deze klasse is aanwezigeen of meer drievoudige obligaties. Acetyleenverbindingen zijn onverzadigd. Dit betekent dat slechts één valentie van koolstof wordt gerealiseerd als gevolg van waterstof. De resterende drie bindingen worden gebruikt in interactie met andere koolstofatomen.
De eerste - en de beroemdste vertegenwoordigeralkynen - acetyleen of ethine. De triviale naam van de stof komt van het Latijnse woord "acetum" - "azijn" en het Grieks - "hyle" - "boom". De grondlegger van de homologe reeks werd in 1836 ontdekt in chemische experimenten, later werd de stof gesynthetiseerd uit steenkool en waterstof door E. Davy en M. Berthelot (1862). Bij gewone temperatuur en normale atmosferische druk bevindt acetyleen zich in een gasvormige toestand. Het is een kleurloos gas, reukloos, nauwelijks oplosbaar in water. Ethine is gemakkelijker oplosbaar in ethanol en aceton.

Etin is het eenvoudigste lid van zijn homologe serie, de samenstelling en structuur weerspiegelen de formules:
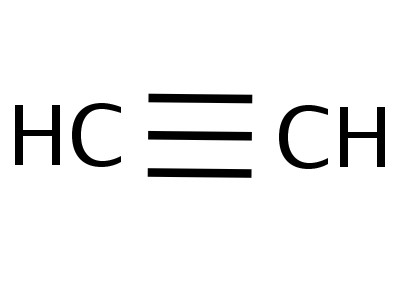
Formules die de verdeling van elektronen laten zien,diende als basis voor het creëren van atomaire orbitale modellen, ruimtelijke formules van moleculen (stereochemisch). Al aan het einde van de 18e eeuw werden modellen met kogelstangen wijdverbreid - bijvoorbeeld ballen van verschillende kleuren en maten, die koolstof en waterstof vertegenwoordigen, die acetyleen vormen. De structuurformule van het molecuul wordt gepresenteerd in de vorm van staafjes die de chemische bindingen en hun hoeveelheid bij elk atoom symboliseren.
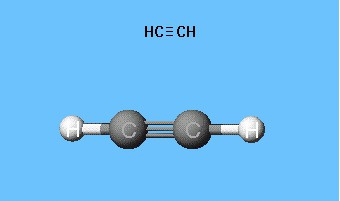
Het sferische staafmodel van acetyleen reproduceertValentiehoeken van 180 °, maar internucleaire afstanden in het molecuul worden ongeveer gereflecteerd. De holtes tussen de ballen creëren niet het idee om de ruimte van atomen te vullen met elektronendichtheid. Het nadeel wordt geëlimineerd in de Drading-modellen, die atoomkernen niet aanduiden door kogels, maar door de bevestigingspunten van de staven aan elkaar. Moderne volumetrische modellen geven een levendiger beeld van atomaire en moleculaire orbitalen.
Koolstof in aangeslagen toestand bevat drie p-orbitalen en een met ongepaarde elektronen. Bij de vorming van methaan (CH4) ze nemen deel aan het creëren van een equivalentbindt met waterstofatomen. De beroemde Amerikaanse onderzoeker L. Pauling ontwikkelde de doctrine van de hybride toestand van atomaire orbitalen (AO). De verklaring van het gedrag van koolstof bij chemische reacties is om AO in vorm en energie, de vorming van nieuwe wolken, gelijk te maken. Hybride orbitalen geven sterkere bindingen, de formule wordt stabieler.
In tegenstelling tot koolstofatomen in een acetyleenmolecuulmethaan ondergaat sp-hybridisatie. In vorm en energie worden s- en p-elektronen gemengd. Er verschijnen twee sp-orbitalen, liggend onder een hoek van 180 °, gericht op tegenoverliggende zijden van de kern.

In acetyleen, hybride elektronenkoolstofwolkendeelnemen aan de vorming van σ-bindingen met dezelfde naburige atomen en met waterstof in C-H-paren. Er blijven twee niet-hybride p-orbitalen loodrecht op elkaar staan. In het ethinemolecuul nemen ze deel aan de vorming van twee π-bindingen. Samen met σ ontstaat een drievoudige binding, wat tot uiting komt in de structuurformule. Acetyleen verschilt van ethaan en ethyleen in de afstand tussen atomen. De drievoudige binding is korter dan de dubbele, maar heeft een grote toevoer van energie, is duurzamer. De maximale dichtheid van σ- en π-bindingen bevindt zich in loodrechte gebieden, wat leidt tot de vorming van een cilindrische elektronenwolk.
Het ethinemolecuul heeft een lineaire vorm, wat succesvol isweerspiegelt de chemische formule van acetyleen - H - C≡C - H. De koolstof- en waterstofatomen bevinden zich langs één rechte lijn, daartussen ontstaan 3 σ- en 2 π-bindingen. Vrije beweging, rotatie langs de C - C as is onmogelijk, dit wordt voorkomen door de aanwezigheid van meerdere bindingen. Andere kenmerken van drievoudige binding:
Ter vergelijking: in ethaan- en ethyleenmoleculen is de lengte van een enkele en dubbele chemische binding respectievelijk 1,54 en 1,34 nm, de C-C-breekenergie is 348 kJ / mol, C = C - 614 kJ / mol.

Acetyleen is de eenvoudigste vertegenwoordiger van alkynen, in de moleculen waarvan er ook een drievoudige binding is. Propin CH3С≡СН - homoloog van acetyleen. De formule van de derde vertegenwoordiger van alkynen - butine-1 - CH3CH2С≡СН. Acetyleen is de triviale naam voor ethine. De systematische nomenclatuur van alkynen voldoet aan de IUPAC-regels:

Ethine en propine hebben geen isomeren van de drievoudige positieverbinding, ze verschijnen, te beginnen met butin. Pentines en daaropvolgende homologen hebben isomeren van het koolstofskelet. Met betrekking tot de drievoudige binding komt het ruimtelijke isomerisme van acetyleenkoolwaterstoffen niet voor.
De eerste 4 homologen van ethine zijn gassen die slecht oplosbaar zijn in water. Acetyleenkoolwaterstoffen C5 - C15 - vloeistoffen. Vaste stoffen zijn ethinehomologen die beginnen met koolwaterstof C17. De chemische aard van alkynen ervaartsignificante invloed van drievoudige binding. Koolwaterstoffen van dit type zijn actiever dan ethyleen, hechten verschillende deeltjes. Het wijdverbreide gebruik van ethine in de industrie en technologie is gebaseerd op deze eigenschap. Bij het verbranden van acetyleen komt veel warmte vrij, die wordt gebruikt bij gassnijden en metaallassen.


























