
Ammoniak - hydrogen nitrid - en av de viktigste nitrogen- og hydrogenforbindelsene. Det er en gass uten farge, men med en skarp lukt. Den kjemiske sammensetningen reflekterer formelen av ammoniakk - NH3. Øk trykk eller lavere temperaturstoffet fører til omdannelsen til en fargeløs væske. Gassformig ammoniakk og dets løsninger er mye brukt i industri og landbruk. I medisin brukes 10% ammoniumhydroksyd - ammoniakk.
Молекула нитрида водорода по форме напоминает en pyramide, på grunnlag av hvilken nitrogen er bundet til tre hydrogenatomer. N-H-bindinger er sterkt polariserte. Nitrogen tiltrekker sterkt bindingselektronparet. Derfor er en negativ ladning akkumulert på N-atomer, en positiv er konsentrert på hydrogen. En ide om denne prosessen er gitt av molekylens modell, den elektroniske og strukturelle formel for ammoniakk.

Vannnitrid er meget løselig i vann.(700: 1 ved 20 ° C). Tilstedeværelsen av praktisk talt fri protoner fører til dannelsen av mange hydrogen "broer" som forbinder molekylene med hverandre. Funksjoner av strukturen og kjemisk binding fører også til det faktum at ammoniakk er lett flytende med økende trykk eller redusert temperatur (-33 ° C).

Begrepet "ammoniakk" ble introdusert i vitenskapelig bruk i1801 på forslag fra den russiske kjemikeren J. Zakharov, men substansen av menneskeheten er kjent fra dyp antikk. Gass med skarp lukt frigjøres ved rotting av avfallsprodukter, mange organiske forbindelser, som proteiner og urea, under dekomponering av ammoniumsalter. Historikere mener at stoffet ble kalt til ære for den gamle egyptiske gud Amon. I Nord-Afrika er det en oase av Siwa (Ammon). Omgitt av den libyske ørkenen er det ruiner av en gammel by og et tempel, ved siden av hvilke det er forekomster av ammoniumklorid. Dette stoffet i Europa ble kalt "saltet av Amun." Det er en legende at innbyggerne i Siwa-oasen snuset salt i templet.
Engelsk fysiker og kjemiker R.I forsøkene brente Boyle gjødsel og observert dannelsen av hvit røyk over en pinne dyppet i saltsyre og ble introdusert i strømmen av den resulterende gass. I 1774 oppvarmet en annen britisk kjemiker, D. Priestley ammoniumklorid med slakket kalk og frigjorde en gassformig substans. Priestley kalte den sammensatte "alkaliske luften", fordi løsningen viste egenskapene til en svak base. Opplevelsen av Boyle, hvor ammoniakk reagerte med saltsyre, ble forklart. Hvit fast ammoniumklorid oppstår når molekylene av reaktantene kommer i kontakt direkte i luften.

Den kjemiske formel for ammoniakk ble etablert i1875 franskmannen K. Berthollet, som gjennomførte et forsøk på nedbrytning av et stoff i dets bestanddeler under virkningen av en elektrisk utladning. Hittil har Priestley, Boyle og Berthollets eksperimenter blitt reprodusert i laboratorier for produksjon av hydrogen nitrid og ammoniumklorid. En industriell metode ble utviklet i 1901 av A. Le Chatelier, som fikk patent på en metode for syntetisering av et stoff fra nitrogen og hydrogen.

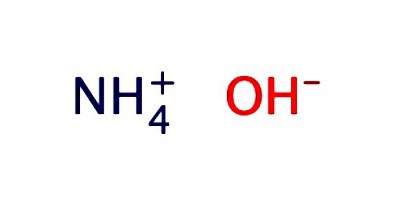
En vandig løsning av ammoniakk registreres vanligvis i form av hydroksid-NH4OH. Den utviser egenskapene til svakt alkali:
Likevekt i reaksjonen av samspillet mellom ammoniakk ogVannskift mot de opprinnelige stoffene. Forvarmet hydrogen nitrid brenner godt i oksygen. Kväve oksyderes til diatomiske molekyler av det enkle stoffet N2. Ammoniak utviser også reduserende egenskaper i reaksjon med kobber (II) oksyd.

Hydrogennitrid brukes i saltproduksjon.ammonium og salpetersyre - en av de viktigste produktene i kjemisk industri. Ammoniak brukes som råmateriale for sodavannproduksjon (ved nitratmetode). Innholdet av hydrogen nitrid i en industriell konsentrert løsning når 25%. I landbruket benyttes en vandig løsning av ammoniakk. Flytende gjødselformel - NH4OH.Stoffet brukes direkte i form av topp dressing. Andre måter å berike jorda med nitrogen er bruken av ammoniumsalter: nitrater, klorider, fosfater. I industrielle forhold og landbrukslokaler anbefales det ikke å lagre mineralgjødsel som inneholder ammoniumsalter med alkalier sammen. Når emballasjenes integritet er kompromittert, kan stoffer reagere med hverandre for å danne ammoniakk og slippe det inn i inneluften. Giftig forbindelse påvirker respiratorisk system, menneskets sentralnervesystem. En blanding av ammoniakk og luft er eksplosiv.


























