
Hendelsene i den fysiske verden er uløselig forbundet medtemperaturendringer. Hver person blir kjent med det i tidlig barndom, når han innser at isen er kald, og han brenner kokende vann. Samtidig kommer forståelsen av at prosessene for temperaturendring ikke forekommer umiddelbart. Senere på skolen lærer studenten at dette skyldes termisk bevegelse. Og prosessene knyttet til temperatur, tildelt en hel del av fysikken.

Dette vitenskapelige konseptet blir introdusert for å erstatte det vanligevilkår. I hverdagen dukker det stadig opp ord som varmt, kaldt eller varmt. Alle av dem snakker om graden av oppvarming av kroppen. Det er slik det er definert i fysikk, bare med tillegg at det er en skalær mengde. Tross alt har temperaturen ingen retning, men bare en numerisk verdi.
I det internasjonale systemet for enheter (SI) temperaturmålt i grader Celsius (ºС). Men i mange formler som beskriver termiske fenomener, er det påkrevd å oversette det til Kelvin (K). Det er en enkel formel for dette: T = t + 273. I den er T temperaturen i Kelvin, og t i Celsius. Konseptet med absolutt null temperatur henger sammen med Kelvin-skalaen.
Det er flere temperaturskalaer.I Europa og Amerika, for eksempel i løpet av Fahrenheit (F). Derfor må de kunne spille inn i Celsius. For å gjøre dette, er det ment å trekke fra 32 vitnesbyrdet i F. og deretter dele det med 1,8.

I hans forklaring er det nødvendig å kjenne konsepter som temperatur, termisk bevegelse. Og å gjennomføre denne opplevelsen er enkelt.
Det vil ta tre containere for det.De skal være store nok slik at hendene lett kan passe. Fyll dem med vann med forskjellige temperaturer. I det første skal det være veldig kaldt. I den andre - oppvarmet. Hell varmt vann i den tredje, der det vil være mulig å holde hånden.
Nå er opplevelsen i seg selv. Senk venstre hånd i en beholder med kaldt vann, til høyre - med det varmeste. Vent et par minutter. Ta dem ut og senk den umiddelbart i et kar med varmt vann.
Resultatet blir uventet.Venstre hånd vil føle at vannet er varmt, høyre hånd vil ha en følelse av kaldt vann. Dette skyldes det faktum at den første termiske likevekten etableres med de væskene som hendene er nedsenket i. Og så forstyrres denne balansen kraftig.
Den beskriver alle termiske fenomener. Men disse påstandene er ganske enkle. Derfor, i en samtale om termisk bevegelse, må disse posisjonene være kjent.
først:stoffer dannes av de minste partiklene som befinner seg i en viss avstand fra hverandre. Dessuten kan disse partiklene være både molekyler og atomer. Og avstanden mellom dem er mange ganger større enn størrelsen på partiklene.
For det andre: den termiske bevegelsen til molekyler blir observert i alle stoffer, som aldri opphører. Partikler i dette tilfellet beveger seg tilfeldig (tilfeldig).
For det tredje: partikler interagerer med hverandre. Denne handlingen skyldes kreftene til tiltrekning og frastøtning. Deres verdi avhenger av avstanden mellom partiklene.
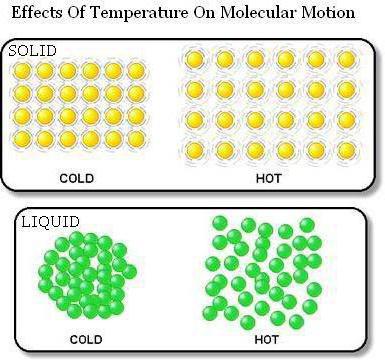
Bevis for at kropper består av partiklersom det er mellomrom, tjener deres termiske utvidelse. Så når kroppen varmes opp, øker størrelsen. Dette skjer på grunn av fjerning av partikler fra hverandre.
En annen bekreftelse på det ovennevnte erdiffusjon. Det vil si penetrering av molekylene til ett stoff mellom partiklene til et annet. Dessuten er denne bevegelsen gjensidig. Diffusjonen går raskere, jo lengre fra hverandre molekylene er. Derfor vil gjensidig penetrering i gasser skje mye raskere enn i væsker. Og i faste stoffer tar diffusjon år.
Forresten forklarer sistnevnte prosess også den termiske bevegelsen. Den gjensidige inntrengningen av stoffer inn i hverandre skjer faktisk uten inngrep utenfra. Men det kan akselereres hvis kroppen varmes opp.
Levende bevis som eksisterertermisk bevegelse er brunsk bevegelse av partikler. Det vurderes for suspenderte partikler, det vil si for de som er vesentlig større enn stoffets molekyler. Disse partiklene kan være støvpartikler eller korn. Og for å få dem til å stole på vann eller gass.
Årsaken til ujevn bevegelse av de vektedepartikler er at molekyler virker på det fra alle sider. Handlingen deres er tilfeldig. Størrelsen på effektene på hvert tidspunkt er forskjellig. Derfor blir den resulterende kraften rettet enten den ene eller den andre veien.
Hvis vi snakker om frekvensen av termiske bevegelser av molekyler, er det et spesielt navn for det - rotens middelkvadrat. Det kan beregnes med formelen:
v = √ [(3 kT) / m0u.
I den er T temperaturen i Kelvin, m0 Er massen til ett molekyl, er k Boltzmann-konstanten (k = 1,38 * 10)-23 J / C).

Partikler blir tiltrukket og frastøtt. I forklaringen av mange prosesser assosiert med termisk bevegelse, er denne kunnskapen viktig.
Tross alt er kreftene for samhandling avhengig av det samledesakens tilstand. Så, gasser har praktisk talt ikke dem, siden partiklene fjernes så mye at effekten ikke blir manifestert. I væsker og faste stoffer er de følbare og sikrer bevaring av stoffets volum. I det siste garanterer de også vedlikehold av form.
Bevis for eksistensen av gravitasjonskrefter ogfrastøtning er utseendet til elastiske krefter under deformasjonen av kropper. Så med forlengelse øker tiltrekningskreftene mellom molekylene, og med kompresjon, frastøtninger. Men i begge tilfeller returnerer de kroppen til den opprinnelige formen.

Det kan skrives fra hoved MKT-ligningen:
(pV) / N = (2E) / 3.
I denne formelen er p trykk, V er volum, N er antall molekyler, E er gjennomsnittlig kinetisk energi.
På den annen side kan denne ligningen skrives som følger:
(pV) / N = kT.
Hvis du kombinerer dem, får du følgende likhet:
(2E) / 3 = kT.
Fra den følger en slik formel for den gjennomsnittlige kinetiske energien til molekyler:
E = (3 kT) / 2.
Dette viser at energi er proporsjonalstoffets temperatur. Det vil si at med en økning i sistnevnte, beveger partikler seg raskere. Dette er essensen av termisk bevegelse, som eksisterer så lenge det er en annen temperatur enn absolutt null.


























