
Amoníaco - nitreto de hidrogênio - um dos compostos mais importantes de nitrogênio e hidrogênio. É um gás sem cor, mas com um odor pungente. A composição química reflete a fórmula da amônia - NH3. Aumentar a pressão ou baixar a temperaturaa substância leva à sua transformação em um líquido incolor. A amônia gasosa e suas soluções são amplamente utilizadas na indústria e na agricultura. Na medicina, o hidróxido de amônio de 10% é usado - amônia.
A molécula de nitreto de hidrogênio tem a forma deuma pirâmide, na base da qual é nitrogênio ligado a três átomos de hidrogênio. As ligações N - H são fortemente polarizadas. O nitrogênio atrai fortemente o par de elétrons de ligação. Portanto, uma carga negativa acumula-se em N átomos, um positivo é concentrado em hidrogênio. Uma idéia desse processo é dada pelo modelo da molécula, a fórmula eletrônica e estrutural da amônia.

O nitreto de hidrogênio é muito solúvel em água.(700: 1 a 20 ° C). A presença de prótons praticamente livres leva à formação de numerosas “pontes” de hidrogênio que conectam as moléculas umas às outras. Características da estrutura e ligação química também levam ao fato de que a amônia é facilmente liquefeita com pressão crescente ou temperatura decrescente (-33 ° C).

O termo "amônia" foi introduzido no uso científico em1801 por sugestão do químico russo J. Zakharov, mas a substância da humanidade é familiar da antiguidade profunda. Gás com um odor pungente é liberado ao apodrecer produtos residuais, muitos compostos orgânicos, como proteínas e uréia, durante a decomposição de sais de amônio. Historiadores da química acreditam que a substância foi nomeada em homenagem ao antigo deus egípcio Amon. No norte da África há um oásis de Siwa (Ammon). Cercado pelo deserto da Líbia, há ruínas de uma cidade antiga e um templo, próximo ao qual há depósitos de cloreto de amônio. Essa substância na Europa era chamada de "sal de Amon". Há uma lenda de que os habitantes do oásis Siwa cheiraram sal no templo.
Físico e químico inglês R.Nos experimentos, Boyle queimou esterco e observou a formação de fumaça branca sobre um bastão embebido em ácido clorídrico e introduzido no fluxo do gás resultante. Em 1774, outro químico britânico, D. Priestley, aqueceu o cloreto de amônio com cal apagada e liberou uma substância gasosa. Priestley chamou o composto de "ar alcalino", porque sua solução mostrava as propriedades de uma base fraca. A experiência de Boyle, na qual a amônia reagiu com ácido clorídrico, foi explicada. Cloreto de amônio sólido branco ocorre quando as moléculas dos reagentes entram em contato diretamente no ar.

A fórmula química da amônia foi estabelecida em1875 pelo francês K. Berthollet, que conduziu um experimento sobre a decomposição de uma substância em seus componentes constituintes sob a ação de uma descarga elétrica. Até agora, os experimentos de Priestley, Boyle e Berthollet foram reproduzidos em laboratórios para produção de nitreto de hidrogênio e cloreto de amônio. Um método industrial foi desenvolvido em 1901 por A. Le Chatelier, que recebeu uma patente para um método para sintetizar uma substância a partir de nitrogênio e hidrogênio.

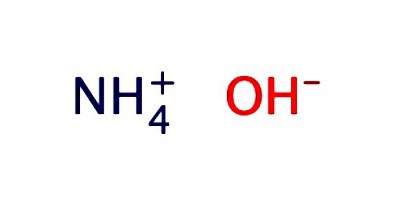
Uma solução aquosa de amônia geralmente é registrada na forma de hidróxido - NH4OH Exibe as propriedades do álcali fraco:
Equilíbrio na reação da interação de amônia coma água muda para as substâncias originais. O nitreto de hidrogênio pré-aquecido queima bem em oxigênio. O nitrogênio é oxidado em moléculas diatômicas da substância simples N2. A amônia também exibe propriedades redutoras em reação ao óxido de cobre (II).

O nitreto de hidrogênio é usado na produção de sal.amônio e ácido nítrico - um dos produtos mais importantes da indústria química. A amônia é usada como matéria-prima para a produção de soda (pelo método do nitrato). O conteúdo de nitreto de hidrogênio em uma solução concentrada industrial atinge 25%. Na agricultura, uma solução aquosa de amônia é usada. Fórmula de Fertilizantes Líquidos - NH4OHA substância é usada diretamente na forma de cobertura. Outras formas de enriquecer o solo com nitrogênio são o uso de sais de amônio: nitratos, cloretos, fosfatos. Em condições industriais e premissas agrícolas não se recomenda guardar em conjunto fertilizadores minerais que contêm sais de amônio com álcalis. Quando a integridade da embalagem é comprometida, as substâncias podem reagir umas com as outras para formar amônia e liberá-la no ar interno. Composto tóxico afeta negativamente o sistema respiratório, o sistema nervoso central do homem. Uma mistura de amônia e ar é explosiva.


























