
Termodinamica ca secțiune independentăștiința fizică a apărut în prima jumătate a secolului al XIX-lea. Vârsta mașinilor a izbucnit. Revoluția industrială a necesitat studierea și înțelegerea proceselor asociate cu funcționarea motoarelor termice. La începutul erei mașinilor, inventatorii singuri nu își permiteau decât să folosească intuiția și „metoda poke”. Nu a existat o ordine publică pentru descoperiri și invenții, nimeni nu și-a putut imagina că ar putea fi utile. Dar când mașinile de căldură (și puțin mai târziu, electrice) au devenit baza producției, situația s-a schimbat. Oamenii de știință au rezolvat treptat confuzia terminologică care a prevalat până la mijlocul secolului al XIX-lea, după ce au decis ce să numim energie, ce forță, ce impuls.
Să începem cu cunoștințe comune.Termodinamica clasică se bazează pe mai multe postulate (principii) care au fost introduse în mod constant de-a lungul secolului al XIX-lea. Adică, aceste dispoziții nu pot fi dovedite în cadrul său. Ele au fost formulate ca urmare a generalizării datelor empirice.
Primul început este aplicarea legii conservăriienergie pentru a descrie comportamentul sistemelor macroscopice (constând dintr-un număr mare de particule). Pe scurt, poate fi formulat după cum urmează: furnizarea de energie internă a unui sistem termodinamic izolat rămâne întotdeauna constantă.
Înțelesul celei de-a doua legi a termodinamicii este de a determina direcția în care procesele se desfășoară în astfel de sisteme.
Al treilea principiu vă permite să determinați cu exactitate o astfel de cantitate ca entropia. Să o luăm în considerare mai detaliat.
Formularea celei de-a doua legi a termodinamicii a fostpropus în 1850 de Rudolf Clausius: „Este imposibilă o tranziție spontană a căldurii de la un corp mai puțin încălzit la unul mai încălzit”. În același timp, Clausius a subliniat meritul lui Sadi Carnot, care a stabilit în 1824 că ponderea energiei care poate fi convertită în funcționarea unui motor termic depinde doar de diferența de temperatură dintre încălzitor și frigider.

Odată cu dezvoltarea ulterioară a celui de-al doilea începuttermodinamică Clausius introduce conceptul de entropie - o măsură a cantității de energie care se transformă ireversibil într-o formă nepotrivită pentru utilizarea în muncă. Clausius a exprimat această valoare prin formula dS = dQ / T, unde dS, care determină schimbarea entropiei. Aici:
dQ este schimbarea căldurii;
T este temperatura absolută (cea măsurată în kelvin).
Exemplu simplu:atingeți capota mașinii dvs. cu motorul pornit. Este în mod clar mai cald decât mediul înconjurător. Dar motorul mașinii nu este conceput pentru a încălzi capota sau apa din radiator. Conversia energiei chimice a benzinei în energie termică, apoi în energie mecanică, face o muncă utilă - rotește arborele. Dar cea mai mare parte a căldurii generate este pierdută, deoarece nu se poate extrage din ea nicio lucrare utilă, iar ceea ce iese din conducta de evacuare nu este nicidecum benzină. În acest caz, energia termică se pierde, dar nu dispare, ci se risipește (se disipă). Un capot fierbinte, desigur, se răcește și fiecare ciclu de cilindru din motor adaugă din nou căldură. Astfel, sistemul caută să realizeze un echilibru termodinamic.
Clausius a dedus un principiu general pentru al doilea începuttermodinamica în formula dS ≥ 0. Sensul său fizic poate fi definit ca entropia „nedescrescătoare”: în procesele reversibile nu se schimbă, în procesele ireversibile crește.
Trebuie remarcat faptul că toate procesele realeireversibil. Termenul „non-descrescător” reflectă doar faptul că o variantă idealizată teoretic posibilă este inclusă și în considerarea fenomenului. Adică, cantitatea de energie indisponibilă în orice proces spontan crește.
Max Planck a adus o contribuție semnificativă la dezvoltaretermodinamica. Pe lângă faptul că a lucrat la interpretarea statistică a celei de-a doua legi, el a participat activ la postularea celei de-a treia legi a termodinamicii. Prima formulare îi aparține lui Walter Nernst și datează din 1906. Teorema lui Nernst are în vedere comportamentul unui sistem de echilibru la temperaturi care tind spre zero absolut. Primul și al doilea principiu al termodinamicii nu permit să aflăm care va fi entropia în condiții date.

La T = 0 K, energia este zero, particulele sistemuluioprește mișcările termice haotice și formează o structură ordonată, un cristal cu o probabilitate termodinamică egală cu unitatea. Aceasta înseamnă că și entropia dispare (mai jos vom afla de ce se întâmplă acest lucru). În realitate, chiar face acest lucru puțin mai devreme, din care rezultă că răcirea oricărui sistem termodinamic, orice corp până la zero absolut este imposibilă. Temperatura se va apropia arbitrar de acest punct, dar nu o va atinge.
Clausius a generalizat și a formulat primul și al doilea principiu al termodinamicii după cum urmează: energia totală a oricărui sistem închis rămâne constantă, iar entropia totală crește cu timpul.
Prima parte a acestei declarații impune o interdicțieO mașină de mișcare perpetuă de primul fel este un dispozitiv care efectuează lucrări fără un flux de energie dintr-o sursă externă. A doua parte interzice, de asemenea, o mașină de mișcare perpetuă de al doilea fel. O astfel de mașină ar traduce energia sistemului în funcționare fără compensarea entropiei, fără a încălca legea conservării. Ar fi posibil să pompăm căldura dintr-un sistem de echilibru, de exemplu, să prăjim ouă sau să turnăm oțel folosind energia mișcării termice a moleculelor de apă, în timp ce o răcim.
Al doilea și al treilea principiu al termodinamicii interzic o mașină de mișcare perpetuă de al doilea fel.
Vai, nu poți obține nimic de la natură, nu doar gratuit, ci trebuie să plătești și un comision.

Există puține concepte în știință care au cauzatla fel de multe emoții ambigue nu numai în rândul publicului larg, ci și în rândul oamenilor de știință înșiși, după cum a explicat entropia. Fizicienii și, în primul rând, Clausius însuși, au extrapolat aproape imediat legea nedescreșterii, mai întâi pe Pământ și apoi pe întregul Univers (de ce nu, deoarece poate fi considerat și un sistem termodinamic). Drept urmare, o cantitate fizică, un element important al calculelor în multe aplicații tehnice, a început să fie percepută ca întruchiparea unui fel de Rău universal, distrugând lumea strălucitoare și amabilă.
Printre oamenii de știință există și astfel de opinii:întrucât, conform celei de-a doua legi a termodinamicii, entropia crește ireversibil, mai devreme sau mai târziu toată energia Universului se va degrada într-o formă împrăștiată și va avea loc „moartea prin căldură”. De ce trebuie să fii fericit? Clausius, de exemplu, a ezitat câțiva ani să-și publice concluziile. Desigur, ipoteza „morții prin căldură” a stârnit imediat multe obiecții. Există îndoieli serioase cu privire la corectitudinea sa chiar și acum.
În 1867, James Maxwell, unul dintre autoriteoria molecular-cinetică a gazelor, într-un experiment foarte vizual (deși fictiv), a demonstrat paradoxalitatea aparentă a celei de-a doua legi a termodinamicii. Experiența poate fi rezumată după cum urmează.
Să existe un vas cu gaz.Moleculele din el se mișcă haotic, viteza lor este ușor diferită, dar energia cinetică medie este aceeași în întregul vas. Acum împărțim vasul cu o partiție în două părți izolate. Viteza medie a moleculelor din ambele jumătăți ale vasului va rămâne aceeași. Partiția este protejată de un demon mic care permite moleculelor mai "rapide" să pătrundă într-o parte și pe cele mai reci "reci" în alta. Ca urmare, în prima jumătate gazul se va încălzi, în a doua se va răci, adică din starea de echilibru termodinamic, sistemul se va deplasa la diferența de potențial de temperatură, ceea ce înseamnă o scădere a entropiei.
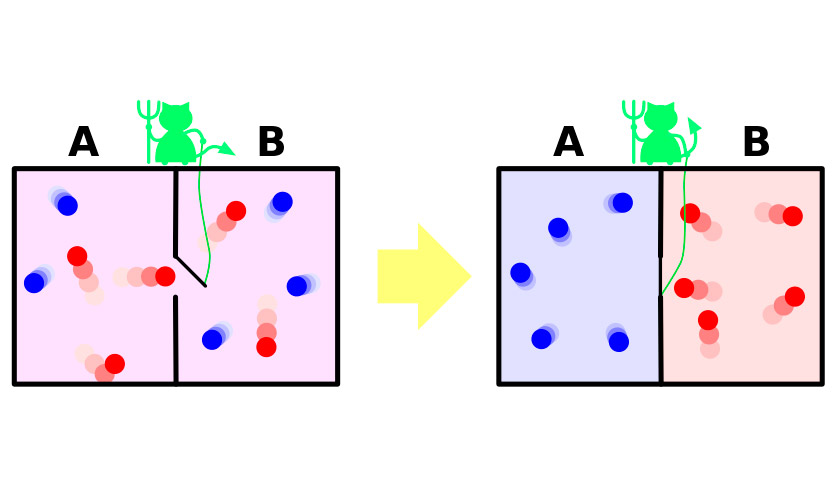
Întreaga problemă este că în experiment sistemulnu face această tranziție spontan. Primește energie din exterior, datorită căreia partiția se deschide și se închide, sau sistemul include în mod necesar un demon care își cheltuie energia pentru îndeplinirea îndatoririlor unui portar. O creștere a entropiei demonului va acoperi mai mult decât o scădere a acestuia într-un gaz.
Luați un pahar cu apă și lăsați-l pe masă.Nu este necesar să observați paharul, este suficient să vă întoarceți după un timp și să verificați starea apei din el. Vom vedea că numărul său a scăzut. Dacă lăsați paharul pentru o lungă perioadă de timp, nu se va găsi deloc apă în el, deoarece toată se va evapora. La începutul procesului, toate moleculele de apă se aflau într-o anumită regiune de spațiu limitată de pereții de sticlă. La sfârșitul experimentului, s-au împrăștiat prin cameră. În volumul unei camere, moleculele au mult mai multe oportunități de a-și schimba locația fără a avea consecințe asupra stării sistemului. Nu vom putea niciodată să-i adunăm într-un „colectiv” sudat și să-i ducem înapoi într-un pahar pentru a bea apă cu beneficii pentru sănătate.

Aceasta înseamnă că sistemul a evoluat până lastare cu entropie mai mare. Pe baza celei de-a doua legi a termodinamicii, entropia sau procesul de împrăștiere a particulelor unui sistem (în acest caz, moleculele de apă) este ireversibil. De ce este așa?
Clausius nu a răspuns la această întrebare și nimeni altcineva nu a putut face acest lucru înainte de Ludwig Boltzmann.
În 1872, acest om de știință a introdus științainterpretarea statistică a celei de-a doua legi a termodinamicii. La urma urmei, sistemele macroscopice cu care se ocupă termodinamica sunt formate dintr-un număr mare de elemente, al căror comportament respectă legile statistice.
Să ne întoarcem la moleculele de apă.Zburând haotic în jurul camerei, pot lua poziții diferite, au unele diferențe de viteză (moleculele se ciocnesc constant între ele și cu alte particule din aer). Fiecare variantă a stării unui sistem de molecule se numește microstat și există un număr mare de astfel de variante. Când sunt implementate majoritatea covârșitoare a opțiunilor, starea macro a sistemului nu se va schimba în niciun fel.
Faimoasa relație S = k lnW conectează numărulposibile modalități prin care se poate exprima un anumit macrostat al unui sistem termodinamic (W), cu entropia sa S. Valoarea lui W se numește probabilitate termodinamică. Forma finală a acestei formule a fost dată de Max Planck. Coeficientul k este extrem de mic (1,38 × 10−23 J / K), care caracterizează relația dintre energie și temperatură, Planck a numit constanta Boltzmann în onoarea omului de știință care a propus mai întâi o interpretare statistică a celei de-a doua legi a termodinamicii.

Este clar că W este întotdeauna un număr natural 1, 2, 3, ... N(nu există un număr fracționat de moduri). Atunci logaritmul lui W și, prin urmare, entropia, nu pot fi negative. La singurul microstat posibil pentru sistem, entropia devine zero. Dacă ne întoarcem la paharul nostru, acest postulat poate fi reprezentat după cum urmează: moleculele de apă, care se grăbesc aleator în jurul camerei, se întorc înapoi la pahar. În același timp, fiecare și-a repetat exact calea și a luat același loc în pahar ca și înainte de zbor. Nimic nu interzice implementarea acestei opțiuni, în care entropia este zero. Așteptați doar implementarea unei probabilități atât de mici, care nu merită. Acesta este un exemplu de ceva care poate fi realizat doar teoretic.
Deci, moleculele zboară haotic în jurul camerei.căi diferite. Nu există regularitate în dispunerea lor, nu există ordine în sistem, indiferent de modul în care modificați variantele de microstate, nu poate fi urmărită nicio structură inteligibilă. A fost la fel în sticlă, dar din cauza spațiului limitat, moleculele nu și-au schimbat poziția în mod activ.
Stare haotică, dezordonată a sistemuluiîntrucât cel mai probabil corespunde entropiei sale maxime. Apa dintr-un pahar este un exemplu de stare de entropie inferioară. Trecerea la acesta de la haosul distribuit uniform în cameră este practic imposibilă.
Să dăm un exemplu mai ușor de înțeles pentru noi toți -curățând mizeria din casă. Pentru a pune totul la locul său, trebuie să cheltuim și energie. În procesul acestei lucrări, ne încălzim (adică nu înghețăm). Se pare că entropia poate fi benefică. Acesta este cazul. Se poate spune și mai mult: entropia și prin ea a doua lege a termodinamicii (împreună cu energia) guvernează Universul. Să aruncăm o altă privire asupra proceselor reversibile. Așa ar arăta lumea dacă nu ar fi entropie: fără dezvoltare, fără galaxii, stele, planete. Fara viata ...

Mai multe informații despre „moartea prin căldură”.Există vești bune. Deoarece, conform teoriei statistice, procesele „interzise” sunt de fapt improbabile, fluctuațiile apar într-un sistem de echilibru termodinamic - încălcări spontane ale celei de-a doua legi a termodinamicii. Ele pot fi cât de mari doriți. Când gravitația este inclusă într-un sistem termodinamic, distribuția particulelor nu va mai fi uniform haotic și starea de entropie maximă nu va fi atinsă. Mai mult, Universul nu este neschimbat, constant, staționar. În consecință, însăși formularea chestiunii „moarte prin căldură” nu are sens.


























