
Amonyak - hidrojen nitrür - nitrojen ve hidrojenin en önemli bileşiklerinden biridir. Renksiz bir gazdır ancak keskin bir kokusu vardır. Kimyasal bileşim amonyak formülü - NH3. Basıncı veya düşük sıcaklığı artırınMadde, renksiz bir sıvıya dönüşmesine yol açar. Gaz amonyak ve çözümleri endüstride ve tarımda yaygın olarak kullanılmaktadır. İlaçta,% 10 amonyum hidroksit kullanılır - amonyak.
Hidrojen nitrür molekülü benzer şekildedirüssünde üç hidrojen atomuna bağlı olan bir piramit. N - H bağları kuvvetle polarize edilir. Azot güçlü bir şekilde bağlanan elektron çiftini çeker. Bu nedenle, negatif bir yük N atomları üzerinde birikir, pozitif olan hidrojen üzerinde yoğunlaşır. Bu süreç hakkında bir fikir, molekülün modeli, amonyakın elektronik ve yapısal formülü ile verilir.

Hidrojen nitrür suda çok çözünür.(20 ° C'de 700: 1). Pratikte serbest protonların varlığı, molekülleri birbirine bağlayan çok sayıda hidrojen “köprüler” in oluşmasına yol açar. Yapının özellikleri ve kimyasal bağlanma, amonyakın artan basınç veya azalan sıcaklıkla (-33 ° C) kolayca sıvılaştırılması gerçeğine de yol açmaktadır.

Термин «аммиак» был введен в научный обиход в Rus kimyacı J. Zakharov'un önerisiyle 1801, ancak insanlığın özü, antik çağlardan tanıdıktır. Atık ürünlerle çürüten gazlar, amonyum tuzlarının ayrışması sırasında proteinler ve üre gibi birçok organik bileşik açığa çıkar. Kimya tarihçileri, maddenin eski Mısır tanrısı Amon'un onuruna verildiğine inanırlar. Kuzey Afrika'da bir Siwa (Ammon) vahası var. Libya çölü ile çevrili bir antik kent ve bir amonyum klorür yatakları bulunan bir tapınak kalıntıları vardır. Avrupa'da bu madde "Amun'un tuzu" olarak adlandırıldı. Siwa vahasının sakinlerinin tapınaktaki tuzu kokladığına dair bir efsane vardır.
İngiliz fizikçi ve kimyager R.Deneylerde, Boyle gübre yaktı ve hidroklorik asit içine batırılmış bir çubuk üzerinde beyaz duman oluşumu gözlemledi ve sonuçta oluşan gazın akışı içine sokuldu. 1774'te, başka bir İngiliz kimyager olan D. Priestley, sönmüş kireç ile amonyum kloriti ısıtmış ve gaz halinde bir madde açığa çıkarmıştır. Priestley, "alkali hava" bileşiğini aradı, çünkü çözeltisi zayıf bir bazın özelliklerini gösterdi. Amonyakın hidroklorik asit ile reaksiyona girdiği Boyle deneyimi açıklandı. Beyaz katı amonyum klorür, reaktiflerin molekülleri doğrudan havaya temas ettiğinde ortaya çıkar.

Amonyak kimyasal formülü kuruldu1875'te bir elektriksel deşarj eylemi altında bir bileşenin bileşen bileşenlerine ayrışması üzerine bir deney yapan Fransız K. Berthollet tarafından. Şimdiye kadar, Priestley, Boyle ve Berthollet'in deneyleri, laboratuarlarda hidrojen nitrür ve amonyum klorür üretimi için yeniden üretilmiştir. 1901'de, bir maddenin nitrojen ve hidrojenden sentezlenmesi için bir yöntem için patent alan A. Le Chatelier tarafından bir endüstriyel yöntem geliştirildi.

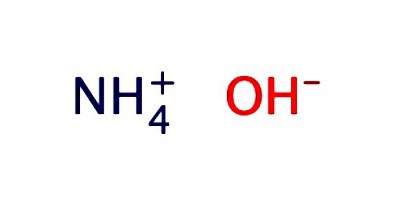
Sulu bir amonyak çözeltisi genellikle hidroksit - NH şeklinde kaydedilir.4OH. Zayıf alkalinin özelliklerini sergiler:
Amonyak ile etkileşiminin reaksiyondaki dengesisu orijinal maddelere doğru kaymaktadır. Ön ısıtılmış hidrojen nitrür oksijende iyi yanar. Azot, basit madde N2'nin diyatomik moleküllerine oksitlenir. Amonyak ayrıca bakır (II) oksit ile reaksiyonda indirgenme özellikleri sergiler.

Tuz üretiminde hidrojen nitrür kullanılır.amonyum ve nitrik asit - kimya endüstrisinin en önemli ürünlerinden biri. Amonyak, soda üretimi için bir hammadde olarak kullanılır (nitrat yöntemi ile). Endüstriyel konsantre bir çözeltideki hidrojen nitrür içeriği% 25'e ulaşır. Tarımda, sulu bir amonyak çözeltisi kullanılır. Sıvı Gübre Formülü - NH4OH.Madde doğrudan üst pansuman şeklinde kullanılır. Toprağı azotla zenginleştirmenin diğer yolları, amonyum tuzlarıdır: nitratlar, klorürler, fosfatlar. Endüstriyel şartlarda ve tarım tesislerinde, alkali ile amonyum tuzları içeren mineral gübrelerin birlikte depolanması önerilmez. Ambalajın bütünlüğü tehlikeye girdiğinde, maddeler amonyak oluşturmak için birbirleriyle reaksiyona girip iç havaya bırakabilirler. Zehirli bileşik, solunum sistemini ve insanın merkezi sinir sistemini olumsuz etkiler. Amonyak ve hava karışımı patlayıcıdır.


























