
Den enkleste flerværdige alkohol, hvoriDer er 3 OH-grupper, - glycerin. Den formel, der er fælles for forbindelser af denne type, er CnH2n - 1 (OH) 3. For bedre at forstå egenskaberne og anvendelsen af glycerol og dets homologer overvejer vi variationerne i formlerne af stoffet, som hver især bruges i visse situationer.
I organisk kemi er alkoholer stofferderivater af kulbrinter. En del af hydrogenatomerne i molekylerne er substitueret med en eller flere hydroxygrupper. Alkoholer adskiller sig i antallet af OH-grupper (mono-, di-, polyatomiske). De lavere repræsentanter for klassen med antallet af carbonatomer fra 1 til 12 er flydende stoffer, jo højere er faste stoffer. Alcantrioler eller glyceriner er triatomiske alkoholer indeholdende tre hydroxyler associeret med tre forskellige carbonatomer. Forbindelser, der hører til denne gruppe, udviser amfotere egenskaber på grund af den gensidige indflydelse af oxygruppen og radikalet.

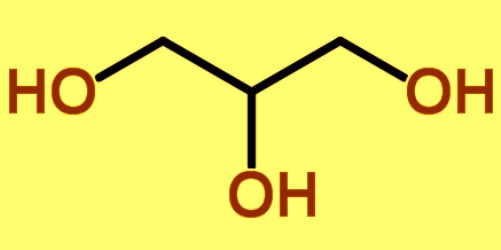
Den enkleste repræsentant for alkanetrioler er propanetriol-1,2,3 (et synonym er glycerin). Formel C -3X8Oh3. Systematisk nomenklatur antyderved at nævne navnet på den tilsvarende alkan med ordet "triol", brugen af arabiske tal, der bestemmer placeringen af OH-gruppen. Nummereringen i molekylerne i glycerolhomologer udføres fra hydroxylen tættest på slutningen af kæden. Mulige typer isomerisme: kulstofkædestruktur, hydroxygruppers placering, optisk.

Den svenske farmaceut K. Scheele modtog først i 1779, når han forsævede fedt, et nyt siruplignende stof. Efter 33 år kaldte franskmanden M. Chevrel den søde flydende glycerin.
Den kemiske sammensætning blev etableret af Peluse i 1836.Et betydeligt bidrag til studiet af strukturen blev ydet af Berthelot (1854) og Wurz (1857), som fortsatte med at studere glycerol. Den radikale molekylformel og karakter gjorde det muligt at tilskrive glycerol til mættede alkoholer.
Behovet for glycerin er steget markant.efter 1847, da salpetersyreesteren blev opdaget. I 1875 lykkedes den svenske ingeniør A. Nobel at skaffe sprængstoffer med dynamit ved hjælp af glycerol.
Den enkleste registrering af stoffets sammensætning falder sammen med den ægte, empiriske og grove glycerolformel - C3X8Oh3. Carbonkæden har 3 atomer hverdem knyttet til en hydroxygruppe. Kemiske symboler angiver de atomer, der udgør stoffet: C - carbon, O - oxygen, H - hydrogen. Sammensætningen af glycerol afspejles i forskellige formler (molekylær, strukturel). I studiet af stof anvendes kuglestang og halvkugleformede modeller i vid udstrækning. To-dimensionelle og tredimensionelle strukturer oprettet ved hjælp af computersimulering er rumlige billeder af et glycerolmolekyle. De giver dig mulighed for at visualisere sammensætningen, den relative position og afstand, koblingsvinklen mellem atomer.

Ved hjælp af formlen kan du finde molekylær og molærmasse, procentdel af elementerne i stoffet. Til beregninger er det nødvendigt at bruge atommasserne af de elementer, der er angivet i den periodiske tabel. Den empiriske formel for glycerin er: C3X5(OH)3. Ved at multiplicere atommassen (i a.u.) af hvert element ved antallet af atomer med den efterfølgende tilsætning af de opnåede værdier finder vi molekylære (Mr) og molære (M) masser. Til denne beregningstype er det mere praktisk at bruge bruttoglycerolformlen - C3X8Oh3.

Stoffets sammensætning og dets molekyler reflekteresrationel og grov formel, men de giver ikke en idé om arrangementet af atomer, som er forskellig glycerin. Strukturformlen og computermodellen er bedre egnet til at studere molekylets struktur, bindingerne mellem atomer.
Nogle typer billeder af et molekyle optager meget plads, derfor bruger de ofte forkortede formler, for eksempel OCHN2—CHON - CH2OH såvel som skeletstrukturer:
Hydroxyl er en polær partikel ud over iltbesidder et ensomt par elektroner. Tilstedeværelsen af tre hydroxygrupper fører til yderligere polarisering af O-H-bindingen. En delvis "+" -ladning vises på carbonatomer, hvilket letter den nukleofile substitution af hydroxyl. Egenskaber ved sammensætningen og strukturen, som afspejler den strukturelle formel for glycerol, bekræftes i stoffets egenskaber. Talrige brintbroer er karakteristiske for denne forbindelse - svage yderligere bindinger. Glycerin har mere udtalt syreegenskaber sammenlignet med ethanol og propanol. Blandt de vigtigste derivater er glyceroltrioleat. formel:

Ved stuetemperatur, propanetriol-1,2,3 -farveløs eller lysegul væske, lugtfri, sød i smagen. Glycerin hærdet ved lave temperaturer smelter ved en temperatur på 17,8 ° C. Kogning af stoffet med efterfølgende fordampning begynder ved 290 ° C. Glycerin er lidt tungere end vand; beregning af dens densitet ved 20 ° C giver en værdi af 1.2604 g / cm3.

Den kemiske formel for glycerin gør det ikkeideer om forbindelsens amfotere karakter. Stoffer med svage sure og basiske egenskaber er forbundet med særegenhederne ved påvirkningen af atomer i et molekyle, polarisering i O - H-gruppen. I nærvær af alkali interagerer glycerol med kobber (II) hydroxid, og der opnås et blåfarvet kompleks (en af de kvalitative reaktioner). Med syrer ender reaktionen af glycerol med dannelsen af estere. Interaktion af en trihydridalkohol med salpetersyre i nærvær af H2CO4 (conc.) fører til dannelse af nitroglycerin.
Hjemme fra fedt og olier ved hjælp afglycerol, ethylalkohol, andre ingredienser får sæbe. Tilberedningsprocessen kræver omhyggelig opvarmning af massen i et vandbad, en kreativ holdning til valg af komponenter og former til det færdige sæbeprodukt.
Glycerin og dets derivater anvendes i emaljer,maling, mange medicin, toiletartikler. Det indeholder et sødt stof i en lang række fødevarer, herunder bagværk. Det internationale navn for sukkererstatning og konfekture er E422. Sammen med andre alkoholer såvel som fedtsyreestere betragtes glycerin som en potentiel erstatning for brændstof, der stammer fra olie. Økonomiske metoder til anvendelse af nye sorter af biodiesel til tankning af biler vil revolutionere den globale transportindustri. Miljøsituationen forbedres markant, verdensøkonomiens afhængighed af olie- og gasproduktion falder.


























