
Η χημεία είναι μια συναρπαστική επιστήμη.Εκείνοι που ενδιαφέρονται όχι μόνο θεωρητικά, αλλά και δοκιμάζουν τις ικανότητές τους στην πράξη, γνωρίζουν ακριβώς τι διακυβεύεται. Κάθε μαθητής είναι εξοικειωμένος με τα περισσότερα από τα στοιχεία του περιοδικού πίνακα. Αλλά όλοι κατάφεραν να προσπαθήσουν να αναμειγνύουν αντιδραστήρια και να διεξάγουν χημικές δοκιμές στη δική τους εμπειρία; Ακόμα και σήμερα, όχι όλα τα σύγχρονα σχολεία διαθέτουν τον απαραίτητο εξοπλισμό και αντιδραστήρια, έτσι η χημεία παραμένει επιστήμη ανοιχτή για ανεξάρτητη μελέτη. Πολλοί προσπαθούν να το ξέρουν πιο βαθιά, διεξάγοντας έρευνα στο σπίτι.

Κανένας οικιακός άνθρωπος δεν μπορεί να κάνει χωρίς άζωτοοξύ - ένα εξαιρετικά σημαντικό πράγμα στο νοικοκυριό. Είναι δύσκολο να αποκτήσετε την ουσία: μπορείτε να την αγοράσετε μόνο σε ένα εξειδικευμένο κατάστημα όπου η αγορά γίνεται σύμφωνα με έγγραφα που επιβεβαιώνουν την ειρηνική χρήση της ουσίας. Ως εκ τούτου, αν είστε ένας κατ 'οίκον πλοίαρχος, η λήψη αυτού του στοιχείου, κατά πάσα πιθανότητα, δεν θα λειτουργήσει. Εδώ τίθεται το ερώτημα πώς να φτιάξουμε νιτρικό οξύ στο σπίτι. Η διαδικασία δεν φαίνεται να είναι περίπλοκη, ωστόσο, η παραγωγή πρέπει να είναι μια ουσία επαρκούς βαθμού καθαρότητας και της απαραίτητης συγκέντρωσης. Εδώ δεν μπορούν να απαλλαγούν οι δεξιότητες ενός πειραματικού χημικού.
Η χρήση του νιτρικού οξέος είναι λογική για ασφαλείς σκοπούς. Η ουσία χρησιμοποιείται στις ακόλουθες σφαίρες της ανθρώπινης δραστηριότητας:

Το καθαρό νιτρικό οξύ, αμετάβλητο, μοιάζει με μια υγρή ουσία που, σε επαφή με τον αέρα, αρχίζει να απελευθερώνει λευκούς ατμούς. Παγώνει ήδη στο -42 oC και βράζει στους +80 oΓ. Πώς να αφαιρέσετε μια ουσία όπως το νιτρικό οξύ με τα χέρια σας στο σπίτι;
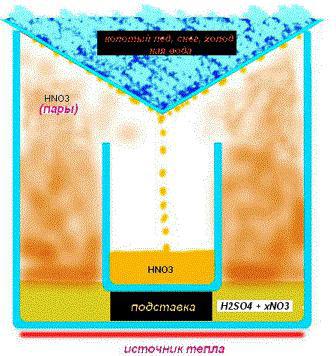
Η αναθυμιάσιμη ουσία λαμβάνεται απόη επίδραση του θειικού οξέος στο νιτρικό νάτριο (κάλιο) νιτρικό νάτριο (κάλιο). Ως αποτέλεσμα της αντίδρασης, λαμβάνονται η επιθυμητή ουσία και όξινο θειικό νάτριο (κάλιο). Το σχήμα αντίδρασης μοιάζει με αυτό: ΝΑΝΟ3+Χ2CO4=>Χνο3+NaHSO4. Να θυμάστε ότι η συγκέντρωση της προκύπτουσας ουσίας εξαρτάται από τη συγκέντρωση θειικού οξέος πριν από την είσοδο στην αντίδραση.
Να πάρει νιτρικό οξύ στο σπίτι μεμια χαμηλότερη συγκέντρωση της ουσίας εμφανίζεται με τον ίδιο τρόπο, είναι απαραίτητο μόνο να αντικατασταθεί το νιτρικό νάτριο με νιτρικό αμμώνιο. Η χημική εξίσωση μοιάζει με αυτό: NN4ΑΛΛΑ3+Χ2CO4=> (NN4)2CO4+Χνο3. Σημειώστε ότι το νιτρικό αμμώνιο είναι πιο εύκολα διαθέσιμο από το νιτρικό κάλιο ή το νάτριο, γι 'αυτό οι περισσότεροι ερευνητές διεξάγουν μια αντίδραση βασισμένη σε αυτό.

Όσο υψηλότερη είναι η συγκέντρωση του Η2CO4, όσο πιο συμπυκνωμένο είναι το άζωτοοξύ. Για να ληφθεί μια ισορροπημένη ουσία, απαιτείται αύξηση του όγκου ηλεκτρολύτη που απαιτείται για την αντίδραση. Για να επιτύχουν το επιθυμητό αποτέλεσμα, στην πράξη, χρησιμοποιούν τη μέθοδο εξάτμισης, η οποία συνίσταται σε σταδιακή μείωση του όγκου του ηλεκτρολύτη κατά περίπου 4 φορές από την αρχική.
Κοσκινισμένη άμμος χύνεται στο κάτω μέρος του πιάτου και βάλτεδεξαμενή ηλεκτρολυτών. Σε αυτήν την περίπτωση, η διαδικασία βρασμού ρυθμίζεται από τη βαλβίδα της σόμπας αερίου, δίνοντας ή μειώνοντας τη φωτιά. Η διαδικασία είναι μακρά, οπότε η υπομονή είναι σημαντική σε ένα τέτοιο θέμα. Οι ειδικοί προτείνουν τη χρήση βραστό νερό - γυάλινους ή κεραμικούς σωλήνες σχεδιασμένους για χημικά πειράματα, συμπεριλαμβανομένης της εξάτμισης. Εξουδετερώνουν το σχηματισμό φυσαλίδων και μειώνουν τη δύναμη βρασμού αποτρέποντας το πιτσίλισμα. Υπό τέτοιες συνθήκες, επιτρέπεται η λήψη νιτρικού οξέος στο σπίτι με συγκέντρωση περίπου 93%.
Για να πραγματοποιήσετε την αντίδραση, θα χρειαστείτε:
Η λήψη νιτρικού οξέος στο σπίτι, όπως η πραγματοποίηση οποιασδήποτε άλλης χημικής αντίδρασης, απαιτεί τη λήψη προφυλάξεων:
Τώρα ξέρετε πώς να φτιάξετε νιτρικό οξύ σε μια απλή αντίδραση. Να είστε προσεκτικοί με αυτήν την ουσία και να την χρησιμοποιείτε μόνο για ειρηνικούς σκοπούς.


























