
En este artículo analizaremos la producción de sulfuro de hidrógeno a partir de azufre. Consideremos con más detalle las propiedades físicas y químicas de esta sustancia.

Для того чтобы проанализировать основное Recibiendo sulfuro de hidrógeno, es necesario conocer las características de su estructura. La composición de esta sustancia contiene un átomo de azufre y dos de hidrógeno. No son metales, por lo que se forman enlaces polares covalentes entre los elementos. En estructura angular de sulfuro de hidrógeno. Se forma un ángulo de 92 grados entre el azufre y el hidrógeno, que es ligeramente menor que en el agua.
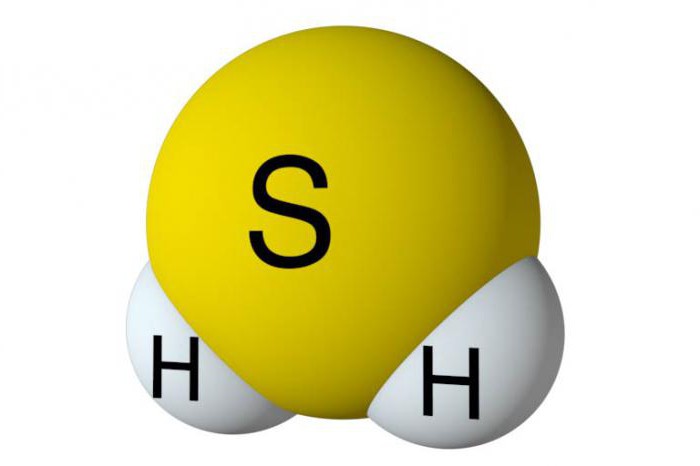
El olor a sulfuro de hidrógeno, que recuerda a los huevos podridos,familiar para todos. En condiciones normales, esta sustancia se encuentra en estado gaseoso. No tiene color, poco soluble en agua, venenoso. En promedio, a 20 grados Celsius, 2.4 volúmenes de sulfuro de hidrógeno se disolverán en agua. Las propiedades ácidas insignificantes se revelaron en agua de sulfuro de hidrógeno, la disociación de la sustancia se desarrolla en pasos. El sulfuro de hidrógeno venenoso es peligroso incluso en pequeñas dosis. El contenido en el aire de aproximadamente 0,1 por ciento de sulfuro de hidrógeno conduce a la parálisis del centro respiratorio con pérdida de conciencia. Por ejemplo, el legendario naturalista Plinio el Viejo murió en el siglo 79 aC, precisamente por el sulfuro de hidrógeno, que se formó durante la erupción del Vesubio.
La causa del efecto de envenenamiento del sulfuro de hidrógeno en su interacción química con la hemoglobina. El hierro contenido en esta proteína forma sulfuro con sulfuro de hidrógeno.
Concentración máxima permisible en el aire.El sulfuro de hidrógeno se considera que es 0.01 mg / l. Como antídoto, se utiliza la inhalación de oxígeno puro o aire, como parte de la cual hay una cantidad insignificante de cloro.
Trabajar con sulfuro de hidrógeno requiere el cumplimiento de ciertas reglas de seguridad. Todos los experimentos relacionados con esta sustancia gaseosa se llevan a cabo en dispositivos sellados y campanas de extracción.

¿Cuál es la recepción de sulfuro de hidrógeno en el laboratorio? La opción más común es la interacción del hidrógeno con el azufre. Esta reacción química se refiere al compuesto contenido en una campana extractora.
Además, la producción de sulfuro de hidrógeno es posible conintercambio entre sulfuro de hierro sólido (2) y una solución de ácido sulfúrico o clorhídrico. Para obtener este resultado, en un tubo de ensayo, es suficiente tomar algunas piezas de sulfuro, sin exceder el tamaño de un guisante. A continuación, se agrega una solución ácida al tubo (hasta la mitad del volumen), se cierra con un tubo de vapor. El dispositivo se coloca bajo el capó, el tubo se calienta. La interacción química está acompañada por la liberación de burbujas de gas. Dicha producción de sulfuro de hidrógeno le permite crear una cantidad de una sustancia suficiente para considerar sus propiedades químicas.
¿Qué otras formas hay?En el laboratorio, el sulfuro de hidrógeno se puede producir haciendo reaccionar hierro metálico (bajo una campana) con azufre cristalino, y luego reaccionando sulfuro con ácido sulfúrico.

El sulfuro de hidrógeno interactúa con el oxígeno del aire,Arde con un color azulado. En el caso de combustión completa, los productos de reacción son óxido de azufre (4) y agua. Teniendo en cuenta que el gas del horno es un óxido ácido, en solución forma un ácido sulfúrico débil, que tiñe de rojo el papel tornasol azul.
En caso de cantidad insuficiente de sulfuro de hidrógeno se forma azufre cristalino. Este proceso se considera un método industrial para obtener azufre puro a partir de sulfuro de hidrógeno.
Este producto químico ha sido identificado yExcelentes habilidades regenerativas. Se manifiestan, por ejemplo, cuando interactúan con sales, halógenos. Para llevar a cabo una reacción similar en condiciones de laboratorio, se vierte una solución de sulfuro de hidrógeno en tubos con cloro y bromo, se observa decoloración La formación de azufre cristalino se observa como el producto de reacción.
La reacción química del sulfuro de hidrógeno con agua conduce a la formación del catión de hidroxonio H3O +.
El sulfuro de hidrógeno es capaz de formar dos tipos de compuestos: sulfuros (sales medias) e hidrosulfuros (sales ácidas).
Sulfuros de metales alcalinos y alcalinotérreosSon compuestos incoloros. En los metales pesados (cobre, níquel, plomo) son negros. El sulfuro de manganeso tiene un color rosado. Muchas sales no se disuelven en el agua.
La reacción cualitativa a los sulfuros se considera interacción con una solución de sulfato de cobre (2). El producto de esta interacción será la precipitación de un precipitado negro de sulfuro de cobre (2).
En la naturaleza, esta sustancia se encuentra en minerales.Fuentes de gases volcánicos. Este compuesto es un producto de la descomposición de animales y organismos vegetales, se distingue por el olor característico del sulfuro de hidrógeno. Los sulfuros naturales se encuentran en la composición de metales raros, en metalurgia los elementos correspondientes se obtienen de ellos. Es importante recordar que el sulfuro de hidrógeno es una sustancia venenosa fuerte.


























