
Vamos a hablar de lo que es OVR en síntesis inorgánica y orgánica.
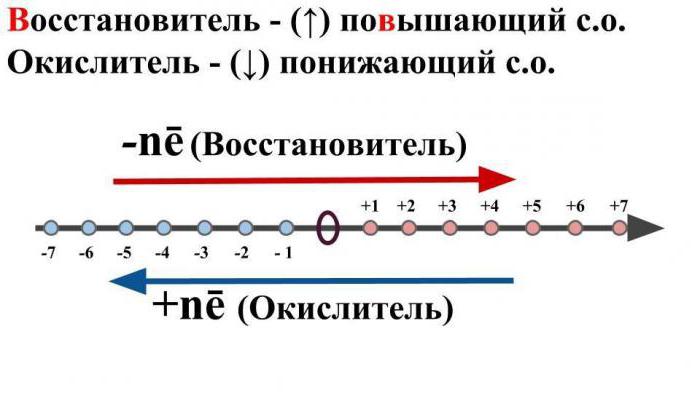
Por reacciones redox se entiende aquellos procesos como resultado de los cuales cambiará el grado de oxidación de dos o más elementos químicos en sustancias complejas o simples.

Под окислением подразумевается такая химическая una reacción en la que un átomo o un ion específico abandona los electrones, al tiempo que reduce su estado de oxidación inicial. Este proceso es característico de los metales.
Por el proceso de recuperación se entiendeTransformación química, como resultado de lo cual el grado de oxidación de un ion o una sustancia simple disminuirá, con la adición de electrones. Esta reacción es característica de no metales y residuos ácidos.

Teniendo en cuenta la cuestión de qué es OVR, es imposible ignorar algo como "agente reductor".
Por esto se entiende una molécula neutra oun ion cargado, que, como resultado de la interacción química, donará un electrón a otro ion o átomo, mientras aumenta su grado de oxidación.

El razonamiento sobre lo que es iad también es importantepara mencionar un término como "oxidante". Debajo de esto es costumbre implicar tales iones o átomos neutros, que durante la interacción química aceptarán electrones negativos de otros átomos o partículas neutras. Sin embargo, su estado de oxidación inicial disminuirá.
Discutiendo sobre lo que es OVR, es necesario tener en cuenta los tipos de estos procesos, que se consideran más a menudo en síntesis inorgánica y orgánica.
Interacciones intermoleculares sugieren talesprocesos por los cuales los átomos del agente reductor y el agente oxidante se ubican en diferentes materiales de partida que interactúan. Como ejemplo de este tipo de transformación, se puede citar una interacción entre el óxido de manganeso (4) y una solución de ácido clorhídrico, que resulta en la formación de gas cloro, cloruro de manganeso divalente y también agua.
En el proceso químico considerado, comoEl agente reductor aparece como aniones de cloro, oxidados como la interacción. El catión de manganeso (con un estado de oxidación de +4) exhibe capacidades de oxidación en la reacción, tomando dos electrones, se reduce
La interacción intramolecular esson tales transformaciones químicas, en la medida en que tanto los átomos del agente reductor como los átomos del agente oxidante son inicialmente el mismo material de partida y, una vez completada la transformación, terminan en diversos productos de reacción.
Como ejemplo de este tipo de reacción puedeIntroducir la descomposición del clorato de potasio. Cuando se calienta, esta sustancia se convertirá en cloruro de potasio y oxígeno. Las propiedades oxidantes serán características del anión del clorato, el cual, tomando cinco electrones en la reacción, se reducirá y se convertirá en cloruro.
En este caso, el anión de oxígeno exhibiráPropiedades reductoras, oxidantes al oxígeno molecular. Entonces, ¿qué es iad en este caso? Este es el proceso de transferencia de electrones entre iones, lo que lleva a la formación de dos productos de reacción.
Также к данному виду химических превращений, El proceso de descomposición del nitrito de amonio está relacionado con los cambios en el grado de oxidación de los elementos originalmente en la misma fórmula. El nitrógeno presente en el catión de amonio, que tiene un estado de oxidación de -3, durante el proceso da seis electrones y se oxida a nitrógeno molecular. Y ese nitrógeno, que es parte del nitrito, acepta seis electrones, mientras que es un agente reductor, y durante la reacción se oxida.
¿Qué es la DAI en química? La definición que consideramos anteriormente indica que estas transformaciones están asociadas con cambios en varios elementos de estados de oxidación.
Самоокисление и восстановление (диспропорция) Asume tales procesos, durante el curso de los cuales un átomo fuente actúa como agente reductor y oxidante, lo que aumentará y simultáneamente reducirá su grado de oxidación después de la finalización de la interacción. Discutiendo sobre el hecho de que OVR está en química, se pueden encontrar ejemplos de tales transformaciones incluso en el curso de la química de la escuela secundaria. La descomposición del sulfito de potasio cuando se calienta conduce a la formación de dos sales de este metal: sulfuro y sulfato. El azufre con un estado de oxidación de +4 exhibe propiedades reductoras y oxidativas, aumentando y disminuyendo el estado de oxidación.
Para entender lo que significa OVR en química, llamemosUn tipo más de tales transformaciones químicas. La contraproporción implica tales procesos, como resultado de lo cual los átomos del agente reductor y el agente oxidante están contenidos en diferentes componentes iniciales, pero en la parte derecha forman un producto de reacción. Por ejemplo, la interacción del óxido de azufre (4) con sulfuro de hidrógeno producirá azufre y agua. Un ion de azufre con un estado de oxidación de +4 aceptará cuatro electrones, mientras que un ion de azufre con un -2 perderá dos electrones. Como resultado, ambos se convierten en una sustancia simple, en la que el grado de oxidación es cero.

Рассматривая вопрос о том, что такое ОВР в химии, Notamos que estas son numerosas transformaciones, gracias a las cuales funcionan los organismos vivos, ocurren diversos procesos y fenómenos naturales. Para ordenar los coeficientes en tales ecuaciones, es necesario hacer un balance electrónico.


























