
हमारे समय में, भौतिकी बहुत आम हो गई हैविज्ञान। यह हर जगह शाब्दिक है। सबसे प्राथमिक उदाहरण: एक सेब का पेड़ आपके यार्ड में बढ़ता है, और उस पर फल पक रहे हैं, समय आता है और सेब गिरने लगते हैं, लेकिन वे किस दिशा में गिरते हैं? सार्वभौमिक गुरुत्वाकर्षण के कानून के लिए धन्यवाद, हमारा फल जमीन पर गिरता है, अर्थात यह नीचे जाता है, लेकिन ऊपर नहीं। यह भौतिकी के सबसे प्रसिद्ध उदाहरणों में से एक था, लेकिन आइए, हम अपने ध्यान को ऊष्मागतिकी की ओर, या अधिक सटीक रूप से, संतुलन को चरणबद्ध करने के लिए दें, जो हमारे जीवन में कम महत्वपूर्ण नहीं हैं।

सबसे पहले, आइए इस शब्द को देखें।ΘερμοΘεναμική- यह एक शब्द है जो ग्रीक में दिखता है। पहले भाग firstρμо का अर्थ है "गर्मी", और दूसरा μναμική - "ताकत"। ऊष्मप्रवैगिकी भौतिकी की एक शाखा है जो एक मैक्रोस्कोपिक प्रणाली के गुणों का अध्ययन करती है, साथ ही साथ ऊर्जा को परिवर्तित करने और स्थानांतरित करने के विभिन्न तरीके हैं। इस खंड में, विभिन्न राज्यों और प्रक्रियाओं का विशेष रूप से अध्ययन किया जाता है ताकि तापमान की अवधारणा को विवरण में पेश किया जा सके (यह एक भौतिक मात्रा है जो एक थर्मोडायनामिक प्रणाली की विशेषता है और कुछ उपकरणों का उपयोग करके मापा जाता है)। थर्मोडायनामिक प्रणालियों में होने वाली सभी प्रक्रियाओं को केवल सूक्ष्म मात्रा (दबाव और तापमान, साथ ही घटकों की एकाग्रता) द्वारा वर्णित किया जाता है।
हर भौतिकशास्त्री इस समीकरण को जानता है, लेकिन हमें बताएंहम इसे भागों में विश्लेषण करेंगे। यह एक निश्चित पदार्थ के एक चरण से दूसरे चरण में संक्रमण की संतुलन प्रक्रियाओं को संदर्भित करता है। यह इस तरह के उदाहरणों में स्पष्ट रूप से देखा जाता है: पिघलने, वाष्पीकरण, उच्च बनाने की क्रिया (उत्पादों को संरक्षित करने के तरीकों में से एक, जो पूरी तरह से नमी को हटाकर होता है)। सूत्र स्पष्ट रूप से चल रही प्रक्रियाओं को दर्शाता है:

Clapeyron-Clausius समीकरण हैऊष्मागतिकी के दूसरे नियम की उत्कृष्ट गणितीय व्याख्या। इसे "क्लॉसियस असमानता" के रूप में भी जाना जाता है। स्वाभाविक रूप से, प्रमेय को वैज्ञानिक ने खुद विकसित किया था, जो सिस्टम और एंट्रॉपी में गर्मी के प्रवाह, साथ ही साथ इसके पर्यावरण के बीच संबंधों को समझाना चाहता था। क्लॉसियस ने एन्ट्रापी की व्याख्या करने और इसे परिमाणित करने के अपने प्रयासों में इस समीकरण को विकसित किया। शाब्दिक अर्थ में, प्रमेय हमें यह निर्धारित करने की अनुमति देता है कि चक्रीय प्रक्रिया प्रतिवर्ती या अपरिवर्तनीय है या नहीं। यह असमानता हमें दूसरे कानून को समझने के लिए एक मात्रात्मक सूत्र प्रदान करती है।
वैज्ञानिक इस विचार पर काम करने वाले पहले लोगों में से एक थेएन्ट्रापी, और यहां तक कि इस प्रक्रिया को एक नाम दिया। अब क्लॉजियस प्रमेय के रूप में जाना जाता है जिसे रूडोल्फ के छठे कार्य में पहली बार 1862 में प्रकाशित किया गया था "आंतरिक कार्य के लिए परिवर्तन समानता प्रमेय के उपयोग पर।" वैज्ञानिक ने एन्ट्रापी और ऊर्जा प्रवाह के बीच आनुपातिक संबंध को गर्म करके दिखाने की कोशिश की (tried क्यू) प्रणाली में।निर्माण में, इस गर्मी ऊर्जा को काम में परिवर्तित किया जा सकता है, और इसे चक्रीय प्रक्रिया के माध्यम से गर्मी में परिवर्तित किया जा सकता है। रूडोल्फ ने साबित किया कि "चक्रीय प्रक्रिया में होने वाले सभी परिवर्तनों का बीजगणितीय योग शून्य से कम या अत्यधिक मामलों में शून्य के बराबर हो सकता है।"

एक पृथक प्रणाली निम्नलिखित में से एक है:
इस तथ्य के बावजूद कि विषय आंतरिक रूप से अपने स्वयं के गुरुत्वाकर्षण को संदर्भित करता है, एक पृथक प्रणाली आमतौर पर बाहरी गुरुत्वाकर्षण और अन्य दूर बलों की सीमाओं से परे ली जाती है।
यह इस तथ्य के विपरीत हो सकता है कि (मेंउष्मागतिकी में प्रयुक्त अधिक सामान्य शब्दावली) एक बंद प्रणाली कहलाती है, जो चयनात्मक दीवारों से घिरी होती है, जिसके माध्यम से ऊर्जा को ऊष्मा या कार्य के रूप में स्थानांतरित किया जा सकता है, लेकिन कोई बात नहीं। और एक खुली प्रणाली के साथ जिसमें पदार्थ और ऊर्जा प्रवेश या बाहर निकलते हैं, हालांकि इसकी सीमाओं के कुछ हिस्सों में विभिन्न अभेद्य दीवारें हो सकती हैं।
एक पृथक प्रणाली संरक्षण कानून का पालन करती है। सबसे अधिक बार, ऊष्मप्रवैगिकी में, पदार्थ और ऊर्जा को अलग-अलग अवधारणाओं के रूप में माना जाता है।
क्वांटम चरण संक्रमणों को समझने के लिए, यह सहायक हैशास्त्रीय परिवर्तनों के साथ उनकी तुलना करें (जिसे थर्मल रिवर्सल भी कहा जाता है)। सीपीटी एक प्रणाली के थर्मोडायनामिक गुणों में पुच्छ बिंदु का वर्णन करता है। यह कण पुनर्गठन को इंगित करता है। एक विशिष्ट उदाहरण ठंड का पानी संक्रमण है, जो एक तरल और एक ठोस के बीच एक चिकनी संक्रमण का वर्णन करता है। शास्त्रीय चरण रूपांतरण प्रणाली की ऊर्जा और इसके थर्मल उतार-चढ़ाव के एन्ट्रापी के बीच प्रतिस्पर्धा के कारण होते हैं।
शास्त्रीय प्रणाली में कोई एंट्रोपी नहीं हैशून्य तापमान और इसलिए, चरण परिवर्तन नहीं हो सकता है। उनके आदेश को थर्मोडायनामिक क्षमता के पहले बंद व्युत्पन्न द्वारा निर्धारित किया जाता है। और, ज़ाहिर है, यह पहले आदेश का है। फेरोमैग्नेट से पैरामैग्नेट तक चरण परिवर्तन निरंतर होते हैं और दूसरा क्रम होता है। ऑर्डर किए गए अव्यवस्थित चरण से ये निरंतर परिवर्तन ऑर्डर पैरामीटर द्वारा वर्णित हैं, जो शून्य के बराबर हैं। उपर्युक्त फेरोमैग्नेटिक परिवर्तन के लिए, ऑर्डर पैरामीटर सिस्टम के कुल चुंबकत्व का प्रतिनिधित्व करेगा।
गिब्स मुक्त ऊर्जा अधिकतम है बिना विस्तार के कार्यों की संख्याएक थर्मोडायनामिक क्लोज्ड सिस्टम (जो गर्मी का आदान-प्रदान कर सकता है और पर्यावरण के साथ काम कर सकता है) से हटाया जा सकता है। यह अधिकतम परिणाम केवल एक पूरी तरह से प्रतिवर्ती प्रक्रिया में प्राप्त किया जा सकता है। जब प्रणाली पहले राज्य से दूसरे में विपरीत तरीके से बदल जाती है, तो गिब्स मुक्त ऊर्जा में कमी उसके वातावरण में सिस्टम द्वारा निष्पादित के बराबर होती है, दबाव बलों के काम को घटाती है।

थर्मोडायनामिक और मैकेनिकल संतुलनऊष्मागतिकी की स्वयंसिद्ध अवधारणा है। यह एक या एक से अधिक प्रणालियों की आंतरिक स्थिति है, जो अधिक या कम पारगम्य या अभेद्य दीवारों से जुड़ी होती हैं। इस अवस्था में, पदार्थ या ऊर्जा से शुद्ध मैक्रोस्कोपिक प्रवाह नहीं होते हैं, या तो एक सिस्टम के भीतर या सिस्टम के बीच।
राज्य की अपनी अवधारणा मेंआंतरिक संतुलन में कोई स्थूल परिवर्तन नहीं है। सिस्टम एक साथ आपसी थर्मल, मैकेनिकल, केमिकल (स्थिरांक) और विकिरण संतुलन में हैं। वे एक ही रूप में हो सकते हैं। इस प्रक्रिया में, सभी प्रजातियों को एक बार और अनंत समय तक संरक्षित किया जाता है जब तक कि शारीरिक ऑपरेशन बाधित न हो जाए। मैक्रोस्कोपिक संतुलन में, पूरी तरह से सटीक संतुलित आदान-प्रदान होता है। उपरोक्त साक्ष्य इस अवधारणा के लिए भौतिक स्पष्टीकरण है।
प्रत्येक कानून, प्रमेय, सूत्र की अपनी नींव है। आइए चरण संतुलन के कानून के 3 मूल पर एक नज़र डालें।

गिब्स फैक्ट्री नियम जोसैया द्वारा प्रस्तावित किया गया थाविलार्ड गिब्स ने अपने प्रसिद्ध लेख में "द इक्विलिब्रियम ऑफ़ हिटरोजेनस सब्सटेंस" शीर्षक दिया, जिसे 1875 से 1878 तक प्रकाशित किया गया था। यह थर्मोडायनामिक संतुलन में गैर-प्रतिक्रियाशील बहुउद्देशीय विषम प्रणालियों पर लागू होता है और यह एक समानता है:
स्वतंत्रता की डिग्री की संख्या निर्लिप्त की संख्या हैगहन चर। तापमान या दबाव जैसे थर्मोडायनामिक मापदंडों की सबसे बड़ी संख्या, जो एक दूसरे को प्रभावित किए बिना एक साथ और मनमाने ढंग से भिन्न हो सकते हैं। एक-घटक प्रणाली का एक उदाहरण एक शुद्ध रसायन के साथ है, जबकि दो-घटक प्रणाली, जैसे पानी और इथेनॉल के मिश्रण में दो स्वतंत्र घटक होते हैं। विशिष्ट चरण संक्रमण (चरण संतुलन) ठोस, तरल पदार्थ, गैस हैं।

सामग्री विज्ञान अनुप्रयोगों के लिए,विभिन्न ठोस संरचनाओं के बीच चरण में परिवर्तन, निरंतर दबाव अक्सर उत्पन्न होता है (उदाहरण के लिए, एक ही वातावरण में) और स्वतंत्रता की डिग्री के रूप में अनदेखा किया जाता है, इसलिए नियम बन जाता है: एफ = सी - पी + 1।
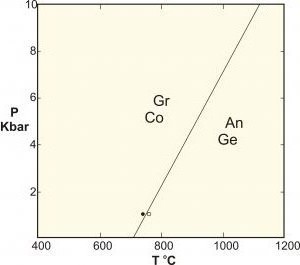
कभी-कभी इस सूत्र को "नियम" नाम से पेश किया जाता हैएक संघनित चरण के साथ ", लेकिन, जैसा कि हम जानते हैं, यह इन प्रणालियों पर लागू नहीं है, जो उच्च दबाव (उदाहरण के लिए, भूविज्ञान में) के अधीन हैं, क्योंकि इन दबावों के परिणाम भयावह परिणाम पैदा कर सकते हैं।
ऐसा लगता है कि चरण संतुलन बस हैएक खाली वाक्यांश, और कुछ शारीरिक प्रक्रियाओं में यह क्षण शामिल है, लेकिन, जैसा कि हमने देखा, हम जानते हैं कि कई कानून इसके बिना काम नहीं करते हैं, इसलिए आपको इन अद्वितीय, रंगीन, थोड़ा उबाऊ नियमों से परिचित होने की आवश्यकता है। इस ज्ञान ने कई लोगों की मदद की है। उन्होंने उन्हें खुद पर लागू करना सीख लिया है, उदाहरण के लिए, इलेक्ट्रीशियन, चरणों के साथ काम करने के नियमों को जानते हुए, खुद को अनावश्यक खतरे से बचा सकते हैं।


























