
Vlastnosti štruktúry acetylénu ovplyvňujú jeho vlastnosti, výrobu a použitie. Symbol zloženia látky - C2H2 — это его простейшая и брутто-формула.Acetylén je tvorený dvomi atómami uhlíka, medzi ktorými vzniká trojitá väzba. Jeho prítomnosť odráža rôzne typy vzorcov a modelov molekuly etínu, ktoré umožňujú pochopiť problém vplyvu štruktúry na vlastnosti látky.
Uhľovodíky alkány alebo acetylén súacyklický, nenasýtený. Reťazec atómov uhlíka nie je uzavretý, obsahuje jednoduché a viacnásobné väzby. Zloženie alkénov odráža kompozitný vzorec CnX2N - 2, V molekulách látok tejto triedy je prítomnýjednu alebo viac trojitých väzieb. Acetylénové zlúčeniny sú nenasýtené. To znamená, že iba jedna valencia uhlíka je spôsobená vodíkom. Zvyšné tri väzby sa používajú pri interakcii s inými atómami uhlíka.
Prvý - a najslávnejší zástupcaalkíny - acetylén alebo etín. Trojitý názov látky pochádza z latinského slova "acetum" - "ocot" a gréckeho - "hyle" - "stromu". Predchodca homológnej série bol objavený v roku 1836 v chemických experimentoch, neskôr bola látka syntetizovaná z uhlia a vodíka E. Devi a M. Berthelot (1862). Pri bežnej teplote a normálnom atmosférickom tlaku je acetylén v plynnom stave. Je to bezfarebný plyn, bez zápachu, málo rozpustný vo vode. Etin sa ľahšie rozpúšťa v etanole a acetóne.

Etin je najjednoduchším členom jeho homológnej série, jeho zloženie a štruktúra odráža vzorce:
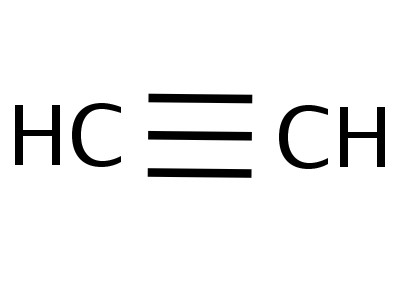
Vzorce znázorňujúce distribúciu elektrónov,slúžil ako základ pre vytvorenie atómovo-orbitálnych modelov, priestorových vzorcov molekúl (stereochemických). Už v druhej polovici 18. storočia sa rozšírili modely guľôčkových ložísk - napríklad gule rôznych farieb a veľkostí, ktoré označujú uhlík a vodík, ktoré vytvárajú acetylén. Štruktúrny vzorec molekuly je reprezentovaný vo forme tyčí, ktoré symbolizujú chemické väzby a ich počet na každom atóme.
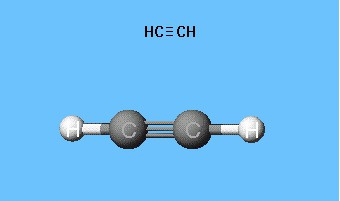
Model reprodukcie acetylénového valčekauhol väzieb rovný 180 °, ale vnútorná nukleárna vzdialenosť v molekule sa približne odráža. Dutiny medzi loptičkami nevytvárajú predstavu o vyplnení priestoru atómov s hustotou elektrónov. Táto nevýhoda je vylúčená v modeloch Dreyding, ktoré označujú atómové jadrá nie guľkami, ale bodmi pripevnenia tyčí k sebe. Moderné objemové modely dávajú živšiu predstavu o atómových a molekulárnych orbitals.
Uhlík v excitovanom stave obsahuje tri p orbitály a jedno s nepárovými elektrónmi. Pri tvorbe metánu (CH4) sú zapojené do vytvárania rovnakej hodnotyväzby s atómami vodíka. Slávny americký výskumník L. Pauling vyvinul teóriu hybridného stavu atómových orbitálov (AO). Vysvetlenie chovania uhlíka v chemických reakciách je zladenie AO v tvare a energii, tvorbe nových oblakov. Hybridné orbitály poskytujú silnejšie spojenia, vzorec sa stáva stabilnejším.
Atómy uhlíka v molekule acetylénu, na rozdiel odmetán podlieha sp-hybridizácii. Tvar a energetický mix s- a p elektrónov. Dve sp orbitály sa objavujú pod uhlom 180 ° smerom na opačné strany jadra.

V acetylénom hybridných uhlíkových elektrónových oblakochpodieľať sa na tvorbe σ-väzieb s rovnakými susednými atómami a vodíkom v pároch C-H. Zostávajú dve nehybridné p-orbitály, ktoré sú navzájom kolmé. V molekule etínu sa podieľajú na tvorbe dvoch p-väzieb. Spolu s σ vzniká trojitá väzba, ktorá sa odráža v štruktúrnom vzorci. Acetylén sa líši od etánu a etylénu vzdialenosťou medzi atómami. Trojnásobná väzba je kratšia ako dvojnásobná, ale má veľkú energetickú rezervu, je odolnejšia. Maximálna hustota väzieb σ a π je umiestnená v kolmých oblastiach, čo vedie k vytvoreniu valcového elektrónového oblaku.
Molekula etínu má lineárnu formu, ktorá je úspešnáodráža chemický vzorec acetylén-H-C = C - H. Atómy uhlíka a vodíka sú pozdĺž jednej priamky, medzi nimi existujú 3 σ- a 2 π-väzby. Voľný pohyb, otáčanie pozdĺž osi C - C nie je možné, čo mu zabraňuje prítomnosť viacerých väzieb. Ďalšie funkcie trojitých väzieb:
Na porovnanie: v molekulách etánu a etylénu je dĺžka jedno- a dvojitých chemických väzieb 1,54 a 1,34 nm, energia pri pretrhnutí C-C je 348 kJ / mol, C = C je 614 kJ / mol.

Acetylén je najjednoduchším zástupcom alkyínov, ktorých molekuly majú tiež trojitú väzbu. Propine CH3C = CH je homológ acetylénu. Vzorec tretieho reprezentatívneho alkyn-butín-1-CH3CH2S≡SN. Acetylén je triviálny názov pre etín. Systémová nomenklatúra alkyns podlieha pravidlám IUPAC:

Etin a propín nemajú triple izomérypripojenia, ktoré sa objavujú, začínajúc s butine. Izoméry uhlíkového skeletu pentínu a nasledujúcich homológov. Vzhľadom na trojitú väzbu sa priestorová izoméria acetylénových uhľovodíkov nezobrazuje.
Prvé 4 homológov etinyl - plyn, zle rozpustné vo vode. Uhľovodíky acetylénu C5 - C15 - kvapaliny. Tuhé látky sú homológy etínu, pričom sa vychádza z uhľovodíka C17, Vzniká chemická povaha alkénovvýznamný efekt trojitých väzieb. Uhľovodíky tohto typu sú účinnejšie ako etylén, viažu rôzne častice. Táto vlastnosť je založená na všeobecnom používaní etínu v priemysle a technológii. Pri spaľovaní acetylénu vzniká veľké množstvo tepla, ktoré sa používa na rezanie plynu a zváranie kovov.


























