
Chémia je fascinujúca veda.Tí, ktorí sa zaujímajú nielen teoreticky, ale tiež vyskúšajú svoje zručnosti v praxi, presne vedia, o čo ide. Každý študent je oboznámený s väčšinou prvkov periodickej tabuľky. Ale podarilo sa každému pokúsiť sa zmiešať činidlá a vykonať chemické testy podľa vlastnej skúsenosti? Dokonca aj dnes nie všetky moderné školy majú potrebné vybavenie a reagencie, takže chémia zostáva vedou otvorenou pre nezávislé štúdium. Mnohí sa snažia poznať to hlbšie a uskutočňujú výskum doma.

Žiadny domáci človek sa neobíde bez dusíkakyselina - v domácnosti mimoriadne dôležitá vec. Je ťažké získať látku: môžete si ju kúpiť iba v špecializovanom obchode, kde sa nákup uskutočňuje podľa dokumentov potvrdzujúcich pokojné používanie látky. Preto, ak ste domáci majster, získanie tohto komponentu pravdepodobne nebude fungovať. Tu vyvstáva otázka, ako vyrobiť kyselinu dusičnú doma. Zdá sa, že tento proces nie je komplikovaný, avšak výstup by mal byť látkou dostatočnej čistoty a potrebnej koncentrácie. V tomto prípade sa nemožno vzdať zručností experimentálneho chemika.
Použitie kyseliny dusičnej je na bezpečné účely primerané. Látka sa používa v týchto oblastiach ľudskej činnosti:

Čistá kyselina dusičná v nezmenenej forme vyzerá ako tekutá látka, ktorá pri kontakte so vzduchom začína vytvárať biele pary. Zamrzne už o -42 oC a teplota varu pri +80 ° C oC. Ako doma odstrániť látky, ako je napríklad kyselina dusičná, vlastnými rukami?
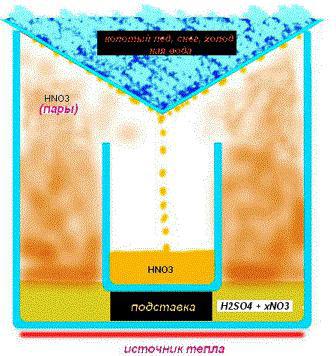
Dymová látka sa získava prostredníctvomúčinok koncentrátu kyseliny sírovej na dusičnan sodný (draselný) (dusičnan sodný). Výsledkom reakcie je požadovaná látka a hydrogensíran sodný (draselný). Reakčná schéma vyzerá takto: NaNO3+X2CO4=>HNO3+NaHSO4. Nezabudnite, že koncentrácia výslednej látky pred vstupom do reakcie závisí od koncentrácie kyseliny sírovej.
Získanie kyseliny dusičnej domarovnaká cesta sa vyskytuje pri nižšej koncentrácii, je potrebné nahradiť iba dusičnan sodný dusičnanom amónnym. Chemická rovnica vyzerá takto: HH4VUT v Brne3+X2CO4=> (HH4)2CO4+HNO3. Všimnite si, že dusičnan amónny je cenovo dostupnejší ako draslík alebo sodík, pretože väčšina vedcov na základe toho uskutočňuje reakciu.

Vyššia koncentrácia H2CO4, čím koncentrovanejší bude dusíkkyselina. Na získanie vyváženej látky je potrebné zvýšiť množstvo elektrolytu potrebné na reakciu. Na dosiahnutie požadovaného výsledku sa v praxi používa metóda odparovania, ktorá spočíva v postupnom znížení objemu elektrolytu asi 4-krát oproti pôvodnému.
Preosiaty piesok sa naleje na dno misiek a umiestni sanádrž na elektrolyt. V tomto prípade je proces varu regulovaný ventilom plynového sporáka, ktorý vydáva alebo redukuje oheň. Tento proces je zdĺhavý, takže v tejto záležitosti je dôležitá trpezlivosť. Odborníci odporúčajú použitie kotlov - sklenených alebo keramických rúr určených na chemické experimenty, vrátane odparovania. Neutralizujú tvorbu bublín a znižujú silu varu, čím bránia postrekovaniu látky. Za týchto podmienok je možné získať kyselinu dusičnú doma s koncentráciou asi 93%.
Pre reakciu prítomnosť:
Získanie kyseliny dusičnej doma, ako aj vykonanie akejkoľvek inej chemickej reakcie, vyžaduje dodržiavanie bezpečnostných opatrení:
Teraz viete, ako získať kyselinu dusičnú jednoduchou reakciou. Pri používaní takejto látky buďte opatrní a používajte ju iba na mierové účely.


























