
Merkmale der Struktur von Acetylen beeinflussen seine Eigenschaften, Produktion und Verwendung. Das Symbol der Zusammensetzung des Stoffes - C2H2 - Dies ist die einfachste und gröbste Formel.Acetylen wird von zwei Kohlenstoffatomen gebildet, zwischen denen eine Dreifachbindung auftritt. Seine Anwesenheit spiegelt die verschiedenen Arten von Formeln und Modellen des Ethin-Moleküls wider, die es ermöglichen, das Problem des Einflusses einer Struktur auf die Eigenschaften einer Substanz zu verstehen.
Kohlenwasserstoffe Alkine oder Acetylen sindazyklisch, ungesättigt. Die Kette von Kohlenstoffatomen ist nicht geschlossen, sie enthält einfache und mehrfache Bindungen. Die Zusammensetzung der Alkine spiegelt die Verbindungsformel C widerHerrX2n - 2. In den Molekülen von Substanzen dieser Klasse ist vorhandeneine oder mehrere Dreifachbindungen. Acetylenverbindungen sind ungesättigt. Dies bedeutet, dass nur eine Kohlenstoffvalenz auf Wasserstoff zurückzuführen ist. Die restlichen drei Bindungen werden bei der Wechselwirkung mit anderen Kohlenstoffatomen verwendet.
Der erste - und der berühmteste VertreterAlkine - Acetylen oder Ethin. Der triviale Name der Substanz stammt von dem lateinischen Wort "acetum" - "Essig" und dem griechischen "hyle" - "Baum". Der Vorfahre der homologen Reihe wurde 1836 in chemischen Experimenten entdeckt. Später wurde die Substanz von E. Devi und M. Berthelot (1862) aus Kohle und Wasserstoff synthetisiert. Bei normaler Temperatur und normalem Atmosphärendruck befindet sich Acetylen in einem gasförmigen Zustand. Es ist ein farbloses Gas, geruchlos, schlecht wasserlöslich. Etin ist leichter in Ethanol und Aceton zu lösen.

Aetin ist das einfachste Mitglied seiner homologen Reihe. Seine Zusammensetzung und Struktur spiegeln die Formeln wider:
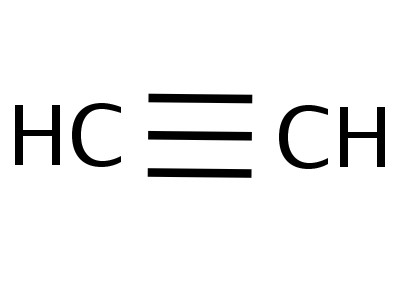
Formeln, die die Verteilung von Elektronen zeigen,diente als Grundlage für die Erstellung von Atomorbitalmodellen, räumlichen Formeln von Molekülen (stereochemisch). Bereits Ende des 18. Jahrhunderts waren Kugellagermodelle weit verbreitet, zum Beispiel Kugeln verschiedener Farben und Größen, die Kohlenstoff und Wasserstoff bedeuten, die Acetylen bilden. Die Strukturformel des Moleküls wird in Form von Stäben dargestellt, die chemische Bindungen und deren Anzahl an jedem Atom symbolisieren.
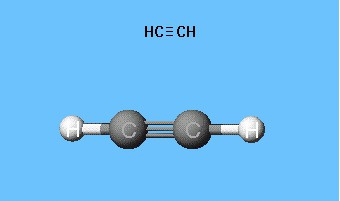
Acetylen-Roller-Stick-Modell reproduziertBindungswinkel gleich 180 °, aber interne Abstände im Molekül werden ungefähr reflektiert. Die Hohlräume zwischen den Kugeln lassen keine Vorstellung von der Füllung des Atoms mit Elektronendichte entstehen. Der Nachteil wird in den Dreyding-Modellen beseitigt, bei denen die Atomkerne nicht durch Kugeln, sondern durch die Anknüpfungspunkte von Stäben bezeichnet werden. Moderne volumetrische Modelle vermitteln eine lebhaftere Vorstellung von Atom- und Molekülorbitalen.
Kohlenstoff enthält im angeregten Zustand drei p-Orbitale und ein s mit ungepaarten Elektronen. Bei der Bildung von Methan (CH4) Sie sind an der Schaffung gleicher Werte beteiligtbindet mit Wasserstoffatomen. Der berühmte amerikanische Forscher L. Pauling entwickelte die Theorie des Hybridzustands von Atomorbitalen (AO). Die Erklärung des Verhaltens von Kohlenstoff in chemischen Reaktionen besteht darin, das AO in Form und Energie auszurichten, die Bildung neuer Wolken. Hybridorbitale ergeben stärkere Verbindungen, die Formel wird stabiler.
Im Unterschied zu den Kohlenstoffatomen im AcetylenmolekülMethan durchläuft eine sp-Hybridisierung. Form und Energie vermischen s- und p-Elektronen. Zwei sp-Orbitale erscheinen in einem Winkel von 180 °, die auf gegenüberliegenden Seiten des Kerns gerichtet sind.

In Acetylen-Hybridkohlenstoffelektronenwolkenbeteiligen sich an der Bildung von σ-Bindungen mit denselben benachbarten Atomen und mit Wasserstoff in CH-Paaren. Es verbleiben zwei rechtwinklig zueinander stehende p-Orbitale. Im Molekül Ethin sind sie an der Bildung von zwei π-Bindungen beteiligt. Zusammen mit σ entsteht eine Dreifachbindung, die sich in der Strukturformel widerspiegelt. Acetylen unterscheidet sich von Ethan und Ethylen durch den Abstand zwischen Atomen. Die Dreifachbindung ist kürzer als das Doppelte, hat jedoch eine große Energiereserve und ist dauerhafter. Die maximale Dichte von σ- und π-Bindungen liegt in senkrechten Bereichen, wodurch sich eine zylindrische Elektronenwolke bildet.
Das Ethinmolekül hat eine lineare Form, was gut istspiegelt die chemische Formel von Acetylen - H - C≡C - H wider. Die Kohlenstoff- und Wasserstoffatome liegen entlang einer geraden Linie, zwischen ihnen entstehen 3 σ- und 2 π-Bindungen. Freie Bewegung, Rotation entlang der CC-Achse ist unmöglich, dies wird durch das Vorhandensein mehrerer Bindungen verhindert. Andere Triple-Bond-Funktionen:
Zum Vergleich: In Ethan- und Ethylenmolekülen beträgt die Länge der einfachen und doppelten chemischen Bindungen 1,54 bzw. 1,34 nm, die CC-Bruchenergie 348 kJ / mol, C = C 614 kJ / mol.

Acetylen ist der einfachste Vertreter von Alkinen, deren Moleküle ebenfalls eine Dreifachbindung aufweisen. Propine CH3C = CH ist ein Homolog von Acetylen. Die Formel des dritten repräsentativen Alkyn-Butins-1-CH3CH2С≡СН. Acetylen ist der Trivialname für Ethin. Die systematische Nomenklatur der Alkine unterliegt den Regeln der IUPAC:

Etin und Propin haben keine DreifachisomereVerbindungen erscheinen sie, beginnend mit butine. Die Kohlenstoffgerüstisomere von Pentin und die folgenden Homologen. In Bezug auf die Dreifachbindung tritt keine räumliche Isomerie von Acetylen-Kohlenwasserstoffen auf.
Die ersten 4 Homologen von Ethin sind Gase, die in Wasser schwer löslich sind. Acetylen-C-Kohlenwasserstoffe5 - C15 - Flüssigkeiten Feststoffe sind Homologe von Ethin, beginnend mit Kohlenwasserstoff C17. Die chemische Natur von Alkinen erfährtsignifikanter Dreifachbindungseffekt. Kohlenwasserstoffe dieses Typs sind aktiver als Ethylen und binden verschiedene Partikel. Diese Eigenschaft basiert auf der weit verbreiteten Verwendung von Ethin in Industrie und Technologie. Beim Verbrennen von Acetylen wird eine große Menge Wärme freigesetzt, die beim Brennschneiden und Schweißen von Metallen verwendet wird.


























