
Minden élő cellában sok vankémiai reakciók. Az enzimek (enzimek) speciális és rendkívül fontos funkciókkal rendelkező proteinek. Biokatalizátoroknak nevezik őket. A protein enzimek fő funkciója a testben a biokémiai reakciók felgyorsítása. A kiindulási reagenseket, amelyek kölcsönhatását ezek a molekulák katalizálják, szubsztrátoknak, a végső vegyületeket termékeknek nevezzük.
A természetben a protein enzimek csak életben működnekrendszereket. De a modern biotechnológiában, a klinikai diagnosztikában, a gyógyszerekben és az orvostudományban tisztított enzimeket vagy ezek komplexeit, valamint kiegészítő elemeket használnak a rendszer működéséhez és az adatok kutató számára történő megjelenítéséhez.

Ezen molekulák nélkül az élő organizmus nem lenne képesműködni. Az életfolyamatok az enzimeknek köszönhetően harmonikusan működnek. A fehérje enzimek fő funkciója a szervezetben az anyagcserének szabályozása. Nélkülük nem lehetséges a normál anyagcsere. A molekulák aktivitásának szabályozása aktivátorok (induktorok) vagy inhibitorok hatására történik. A kontroll a protein szintézis különböző szintjein működik. A kész molekula vonatkozásában „dolgozik”.
A protein enzimek fő tulajdonságai a következők:egy adott hordozó specifitása. Ennek megfelelően az a képesség, hogy csak egy vagy kevésbé gyakran reagáljon egy sor reakcióra. Ezek a folyamatok általában visszafordíthatók. Mindkét funkció elvégzéséért egy enzim felelős. De ez még nem minden.

Az enzimfehérjék szerepe nélkülözhetetlen.Nélkülük nem fordulnak elő biokémiai reakciók. Az enzimek hatására a reagensek jelentős energiaköltségek nélkül képesek legyőzni az aktivációs gátat. A testben nem lehet 100 ° C-ot meghaladó hőmérsékletet felmelegedni, vagy agresszív alkotóelemeket használni, például egy kémiai laboratóriumban. A protein enzim kötődik a szubsztrátumhoz. Egy kötött állapotban módosul az utóbbi későbbi felszabadulása. Így működnek az összes kémiai szintézisben alkalmazott katalizátor.
Ezeknek a molekuláknak általában tercier (földgömb) vagyKvarteráris (több összekapcsolt földgömb) fehérjeszerkezete. Először lineáris formában szintetizálják. És akkor összeomlik a szükséges szerkezetbe. Az aktivitás biztosítása érdekében a biokatalizátornak bizonyos struktúrára van szüksége.

Az enzimeket, mint más fehérjéket, melegítés, szélsőséges pH és agresszív kémiai vegyületek pusztítják el.
Közülük megkülönböztetjük az alkatrészek következő jellemzőit:
Az enzimek specifitásának szintje változik.De bármelyik enzim mindig aktív egy adott szubsztrát vagy vegyületcsoport ellen, amelyek szerkezete hasonló. A nem fehérje katalizátorok nem rendelkeznek ezzel a tulajdonsággal. A specifitást a kötési állandóval (mol / L) lehet mérni, amely elérheti a 10-et-10 mol / l Az aktív enzim gyorsan működik.Egy molekula másodpercenként több ezer és millió műveletet katalizál. A biokémiai reakciók gyorsulási sebessége szignifikánsan (1000-100000-szer) magasabb, mint a hagyományos katalizátoroké.
Az enzimek működése többre épülmechanizmusokat. A legegyszerűbb kölcsönhatás egyetlen szubsztrát molekulával történik, amelyet a termék képződése követ. A legtöbb enzim 2-3 különböző molekulát képes megkötni, amelyek reakcióba lépnek. Például egy csoport vagy atom áthelyezése egyik vegyületből a másikba vagy kettős helyettesítés a "ping pong" elv szerint. Ezekben a reakciókban az egyik szubsztrátumot általában kombinálják, a másik pedig egy funkcionális csoporton keresztül kötődik az enzimhez.
Az enzim hatásmechanizmusának vizsgálata az alábbi módszerekkel történik:

A szubsztrát molekula sokkal kisebbmint egy fehérje enzim. Ezért kötődés történik a biokatalizátor kevés funkcionális csoportja miatt. Ezek aktív centrumot képeznek, amely egy meghatározott aminosav-készletből áll. A komplex fehérjékben a nem fehérje jellegű protéziscsoport van jelen a szerkezetben, amely szintén része lehet az aktív központnak.
Külön enzimek csoportját kell megkülönböztetni.A molekulában van egy koenzim, amely folyamatosan kötődik a molekulához és megszabadul tőle. A teljesen kialakult fehérje enzimet holoenzimnek hívják, és amikor a kofaktor eltávolításra kerül, enzimnek nevezik. A koenzimek gyakran vitaminok, fémek, nitrogén bázisok származékai (NAD - nikotinamid adenin dinukleotid, FAD - flavin adenin dinukleotid, FMN - flavin mononukleotid).
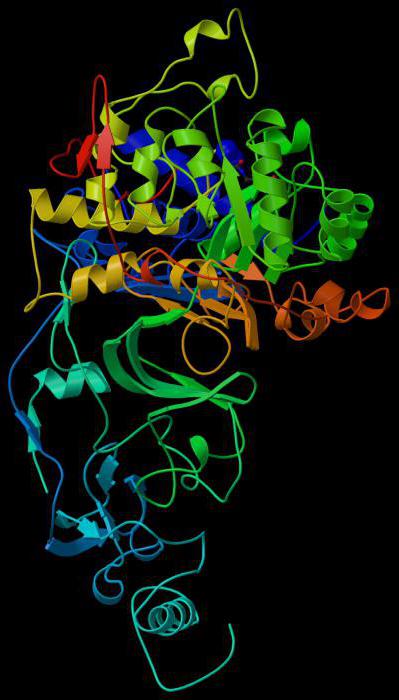
A kötési központ specifitást biztosítaffinitás a szubsztráttal szemben. Ennek köszönhetően stabil szubsztrát-enzim komplex képződik. A földgömb felépítése oly módon van kialakítva, hogy egy fülke (rés vagy üreg) legyen egy bizonyos méretű felületen, amely biztosítja az alj megkötését. Ez a zóna általában az aktív központ közelében található. Az egyes enzimeknek vannak helyszínei a kofaktorokkal vagy fémionokkal való kötéshez.
A fehérje enzim fontos szerepet játszik a szervezetben.Ezek az anyagok kémiai reakciókat katalizálnak, felelősek az anyagcseréhez - az anyagcseréhez. Bármely élő sejtben folyamatosan biokémiai folyamatok százai fordulnak elő, beleértve a reakciók csökkentését, a vegyületek felhasítását és szintézisét. Az anyagok folyamatos oxidációja nagy energiakibocsátással. Ezt viszont a szénhidrátok, fehérjék, zsírok és ezek komplexeinek képzésére fordítják. A hasítási termékek a szükséges szerves vegyületek szintézisének szerkezeti elemei.


























