
Amoniac - nitrură de hidrogen - unul dintre cei mai importanți compuși ai azotului și hidrogenului. Este un gaz fără culoare, dar cu un miros înțepător. Compoziția chimică reflectă formula amoniacului - NH3. Creșteți presiunea sau temperaturi mai scăzutesubstanța conduce la transformarea sa într-un lichid incolor. Amoniacul gazos și soluțiile sale sunt utilizate pe scară largă în industrie și agricultură. În medicină se utilizează hidroxid de amoniu 10% - amoniac.
Molecula de nitrura de hidrogen are o formă asemănătoareo piramidă, la baza căreia este legat azot la trei atomi de hidrogen. Legăturile N - H sunt puternic polarizate. Azotul atrage puternic perechea electronilor de legare. Prin urmare, o sarcină negativă se acumulează pe atomii de N, una pozitivă este concentrată pe hidrogen. O idee a acestui proces este dată de modelul moleculei, formula electronică și structurală a amoniacului.

Hidrogenul nitric este foarte solubil în apă.(700: 1 la 20 ° C). Prezența protonilor practic liberi conduce la formarea numeroaselor "poduri" de hidrogen care leagă moleculele una de cealaltă. Caracteristicile structurii și legăturii chimice conduc, de asemenea, la faptul că amoniacul este ușor lichefiat cu o presiune crescătoare sau o temperatură descrescătoare (-33 ° C).

Termenul "amoniac" a fost introdus în utilizarea științifică în1801 la sugestia chemistului rus J. Zakharov, dar substanța omenirii este cunoscută din vechime. Gazul cu miros mirositor se eliberează atunci când se descompun deșeurile, mulți compuși organici, cum ar fi proteinele și ureea, în timpul descompunerii sărurilor de amoniu. Istoricii chimiei cred că substanța a fost numită în onoarea vechiului zeu egiptean Amon. În Africa de Nord există o oază de Siwa (Amon). Înconjurat de deșertul libian, există ruine ale unui oraș antic și un templu, alături de care există depozite de clorură de amoniu. Această substanță din Europa a fost numită "sarea lui Amun". Există o legendă că locuitorii oasului Siwa au adus sare în templu.
Fizician și chimist englez R.În experimente, Boyle a ars gunoi de grajd și a observat formarea de fum alb peste un băț înmuiat în acid clorhidric și introdus în curentul de gaz rezultat. În 1774, un alt chimist britanic, D. Priestley, a încălzit clorura de amoniu cu var de ars și a eliberat o substanță gazoasă. Priestley a numit compusul "aer alcalin", deoarece soluția sa a arătat proprietățile unei baze slabe. A fost explicată experiența lui Boyle, în care amoniacul a reacționat cu acidul clorhidric. Clorura de amoniu solidă solidă apare atunci când moleculele reactanților intră în contact direct în aer.

Formula chimică a amoniacului a fost stabilită în1875 de către francezul K. Berthollet, care a efectuat un experiment cu privire la descompunerea unei substanțe în componentele sale constitutive sub acțiunea unei descărcări electrice. Până în prezent, experimentele lui Priestley, Boyle și Berthollet au fost reproduse în laboratoare pentru producerea de nitrură de hidrogen și clorură de amoniu. O metodă industrială a fost dezvoltată în 1901 de către A. Le Chatelier, care a primit un brevet pentru o metodă de sintetizare a unei substanțe din azot și hidrogen.

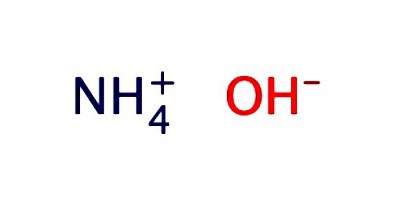
O soluție apoasă de amoniac este de obicei înregistrată sub formă de hidroxid - NH4OH. Ea prezintă proprietățile slab alcaline:
Равновесие в реакции взаимодействия аммиака с apa se deplasează spre substanțele originale. Nitruria de hidrogen preîncălzită arde bine în oxigen. Azotul este oxidat la moleculele diatomice ale substanței simple N2. Amoniacul prezintă, de asemenea, proprietăți de reducere în reacție cu oxidul de cupru (II).

Hidrogen nitru este utilizat în producția de sare.amoniu și acid azotic - unul dintre cele mai importante produse ale industriei chimice. Amoniacul este utilizat ca materie primă pentru producerea de sifon (prin metoda nitratului). Conținutul de nitrură de hidrogen într-o soluție concentrată industrială atinge 25%. În agricultură, se utilizează o soluție apoasă de amoniac. Formulă de îngrășăminte lichide - NH4OH.Substanța este utilizată direct sub formă de pansament superior. Alte metode de îmbogățire a solului cu azot sunt utilizarea sărurilor de amoniu: nitrați, cloruri, fosfați. În condițiile industriale și în spațiile agricole nu se recomandă depozitarea îngrășămintelor minerale care conțin săruri de amoniu împreună cu alcalii. Atunci când integritatea ambalajului este compromisă, substanțele pot reacționa una cu cealaltă pentru a forma amoniac și a le elibera în aerul interior. Compusul toxic afectează în mod negativ sistemul respirator, sistemul nervos central al omului. Un amestec de amoniac și aer este exploziv.


























