
Карактеристике структуре ацетилена утичу на његове особине, производњу и употребу. Симбол састава супстанце - Ц2Х2 Да ли је његова најједноставнија и бруто формула. Ацетилен се састоји од два атома угљеника, између којих постоји трострука веза. Његово присуство огледа се у различитим врстама формула и модела молекула етина, који омогућавају разумевање проблема утицаја структуре на својства супстанце.
Алкини или ацетиленски угљоводоници суацикличан, незасићен. Ланац атома угљеника није затворен, он садржи једноставне и вишеструке везе. Састав алкина огледа се у резиме формули Ц.нКс2н - 2... Молекули супстанци ове класе садржеједна или више троструких веза. Ацетиленска једињења су незасићена. То значи да се само једна валенца угљеника остварује на штету водоника. Преостале три везе се користе у интеракцији са другим атомима угљеника.
Први - и најпознатији представникалкини - ацетилен или етин. Тривијални назив супстанце потиче од латинске речи „ацетум“ - „сирће“ и грчког - „хиле“ - „дрво“. Предак хомологне серије откривен је 1836. године у хемијским експериментима, касније су супстанцу синтетизовали из угља и водоника Е. Дави и М. Бертхелот (1862). На собној температури и нормалном атмосферском притиску, ацетилен је у гасовитом стању. То је безбојни гас, без мириса, слабо растворљив у води. Етин се лакше раствара у етанолу и ацетону.

Етин је најједноставнији члан његове хомологне серије, његов састав и структура одражавају формуле:
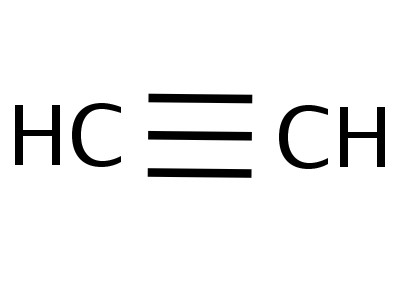
Формуле које показују расподелу електрона,послужио је као основа за стварање атомско-орбиталних модела, просторних формула молекула (стереохемијских). Крајем 18. века модели са шипкама постали су широко распрострањени - на пример, куглице различитих боја и величина, које означавају угљеник и водоник, који формирају ацетилен. Структурна формула молекула представљена је у облику штапића, симболизујући хемијске везе и њихов број у сваком атому.
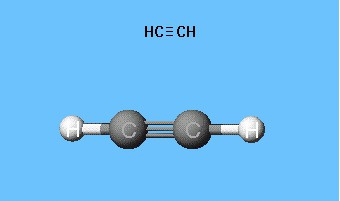
Модел ацетилена са кугличним штапом се репродукујеуглови везе једнаки 180 °, али се међусобна растојања у молекулу приближно одражавају. Празнине између куглица не стварају идеју да простор атома попуне густином електрона. Недостатак је елиминисан у Дреидинговим моделима, који језгра атома не означавају куглицама, већ тачкама причвршћивања шипки једна за другу. Савремени волуметријски модели пружају јаснију слику атомских и молекуларних орбитала.
Угљеник у побуђеном стању садржи три п-орбитале и један с неспареним електронима. Формирањем метана (ЦХ4) учествују у стварању једнакихвезе са атомима водоника. Познати амерички истраживач Л. Паулинг развио је теорију хибридног стања атомских орбитала (АО). Објашњење понашања угљеника у хемијским реакцијама лежи у поравнању АО у облику и енергији и стварању нових облака. Хибридне орбитале дају чвршће везе, формула постаје стабилнија.
Атоми угљеника у молекулу ацетилена, за разлику одметан се подвргава сп-хибридизацији. С- и п електрони су мешани у облику и енергији. Појављују се две сп орбитале, које леже под углом од 180 °, усмерене на супротне стране језгра.

У ацетилену, хибридни електронски облаци угљеникаучествују у стварању σ-веза са истим суседним атомима и са водоником у паровима Ц - Х. Остају две нехибридне п-орбитале окомите једна на другу. У молекулу етина учествују у стварању две π-везе. Заједно са σ настаје трострука веза, што се одражава структурном формулом. Ацетилен се разликује од етана и етилена у растојању између атома. Трострука веза је краћа од двоструке, али има велику залиху енергије и трајнија је. Максимална густина σ- и π-веза налази се у окомитим областима, што доводи до стварања цилиндричног облака електрона.
Молекул етина има линеарни облик, што је повољноодражава хемијску формулу ацетилена - Х - Ц≡Ц - Х. Атоми угљеника и водоника налазе се дуж једне праве линије, између њих настају 3 σ- и 2 π-везе. Слободно кретање, ротација дуж осе Ц - Ц је немогуће, то спречава присуство вишеструких веза. Остале карактеристике троструке везе:
Поређења ради: у молекулима етана и етилена дужине појединачне и двоструке хемијске везе су 1,54, односно 1,34 нм, енергија прекида Ц - Ц је 348 кЈ / мол, Ц = Ц - 614 кЈ / мол.

Ацетилен је најједноставнији представник алкина, чији молекули садрже и троструку везу. Пропин ЦХ3СЈСН - хомолог ацетилена. Формула трећег представника алкина - бутин-1 - ЦХ3ЦХ2СЈСН. Ацетилен је тривијалан назив за етин. Систематска номенклатура алкина подлеже ИУПАЦ правилима:

Етин и пропин немају изомере са троструким положајемвезе, појављују се почев од бутина. Изомери угљеничног скелета налазе се у пентину и хомолозима који га прате. Просторна изомерија ацетилен угљоводоника се не појављује у односу на троструку везу.
Прва 4 хомолога етина су гасови који су слабо растворљиви у води. Угљоводоници ацетилена Ц.5 - Ц.15 - течности. Чврсте материје су етински хомолози који почињу са угљоводоником Ц.17... Испитивања хемијске природе алкиназначајан утицај троструке везе. Угљоводоници ове врсте активнији су од етилена, вежући различите честице. На овом својству се заснива широко распрострањена употреба етена у индустрији и технологији. Када ацетилен сагорева, ослобађа се велика количина топлоте која се користи у сечењу гаса и заваривању метала.


























