
Funktioner av acetylens struktur påverkar dess egenskaper, produktion och användning. Symbolen för ämnets sammansättning - C2H2 - Detta är dess enklaste och brutto formel.Acetylen bildas av två kolatomer, mellan vilka en trippelbindning inträffar. Dess närvaro återspeglar olika typer av formler och modeller av etylmolekylen, vilket gör det möjligt att förstå problemet med strukturens påverkan på substansens egenskaper.
Kolväten alkyner eller acetylen äracykliska, omättade. Kedjan av kolatomer är inte stängd, den innehåller enkla och flera bindningar. Sammansättningen av alkyner speglar kompositformeln CnX2N - 2. I molekylerna av ämnen i denna klass är närvarandeen eller flera trippelbindningar. Acetylenföreningarna är omättade. Detta innebär att endast en kolvalentitet beror på väte. De återstående tre bindningarna används i interaktionen med andra kolatomer.
Den första - och den mest kända representantenalkyner - acetylen eller etin. Ämnetets triviala namn kommer från latinska ordet "acetum" - "vinäger" och det grekiska - "hyle" - "trädet". Föreningen av den homologa serien upptäcktes 1836 i kemiska experiment, senare syntetiserades substansen från kol och väte av E. Devi och M. Berthelot (1862). Vid vanlig temperatur och normalt atmosfärstryck är acetylen i gasformigt tillstånd. Det är en färglös gas, luktfri, dåligt löslig i vatten. Etin är lättare att lösa upp i etanol och aceton.

Etin är den enklaste medlemmen i sin homologa serie, dess sammansättning och struktur återspeglar formlerna:
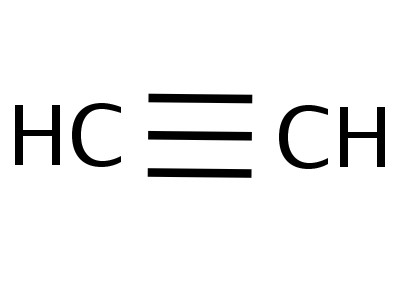
Formler som visar fördelningen av elektroner,fungerade som grunden för skapandet av atombomitalmodeller, rumsliga formler för molekyler (stereokemiska). Redan i slutet av 1700-talet blev kulstångsmodeller utbredda - till exempel kulor i olika färger och storlekar, representerande kol och väte, som bildar acetylen. Strukturformeln för molekylen presenteras i form av stavar som symboliserar kemiska bindningar och deras antal vid varje atom.
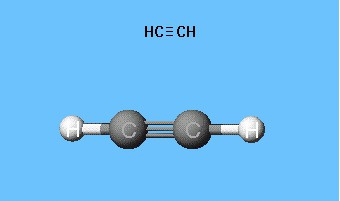
Den sfäriska stavmodellen av acetylen reproducerar180 ° valensvinklar, men internukleära avstånd i molekylen återspeglas ungefär. Hålrummen mellan kulorna skapar inte idén att fylla utrymmet hos atomer med elektrondensitet. Nackdelen elimineras i Drading-modellerna, som betecknar atomkärnor inte med bollar, utan genom fästpunkter för stänger till varandra. Moderna volumetriska modeller ger en mer levande uppfattning om atomära och molekylära orbitaler.
Kol i det upphetsade tillståndet innehåller tre p-orbitaler och en s med oparade elektroner. Vid bildning av metan (CH4) de deltar i att skapa likvärdigabindningar med väteatomer. Den berömda amerikanska forskaren L. Pauling utvecklade läran om hybridtillståndet i atomiska orbitaler (AO). Förklaringen av kolens beteende vid kemiska reaktioner är att anpassa AO i form och energi, bildandet av nya moln. Hybrid orbitaler ger starkare bindningar, formeln blir mer stabil.
Kolatomer i en acetylenmolekyl, till skillnad frånmetan genomgår sp-hybridisering. I form och energi blandas s- och p-elektroner. Två sp-orbitaler visas, liggande i en vinkel på 180 °, riktade mot motsatta sidor av kärnan.

I acetylen, hybrid elektron kol koldelta i skapandet av σ-bindningar med samma angränsande atomer och med väte i C - H-par. Det återstår två icke-hybridp-orbitaler vinkelräta mot varandra. I etinmolekylen deltar de i bildandet av två π-bindningar. Tillsammans med σ uppstår en trippelbindning, vilket återspeglas i strukturformeln. Acetylen skiljer sig från etan och eten i avståndet mellan atomer. Trippelbindningen är kortare än det dubbla, men har en stor energiförsörjning, är mer hållbar. Den maximala densiteten för σ och π-bindningar finns i vinkelräta regioner, vilket leder till bildandet av ett cylindriskt elektronmoln.
Etinmolekylen har en linjär form, vilket är framgångsriktåterspeglar den kemiska formeln för acetylen - H - C≡C - H. Kol- och väteatomerna är belägna längs en rak linje, mellan dem finns 3 σ och 2 π-bindningar. Fri rörelse, rotation längs C - C - axeln är omöjlig, detta hindras av förekomsten av flera bindningar. Andra funktioner i trippelbindning:
Som jämförelse: i etan- och etenmolekyler är längden på en enda och dubbel kemisk bindning 1,54 respektive 1,34 nm är den C-C brytande energin 348 kJ / mol, C = C - 614 kJ / mol.

Acetylen är den enklaste representanten för alkyner, i molekylerna som det också finns en trippelbindning. Propin CH3С≡СН - homolog av acetylen. Formeln för den tredje representanten för alkyner - butin-1 - CH3CH2С≡СН. Acetylen är det triviala namnet på etin. Den systematiska nomenklaturen för alkyner följer IUPAC-reglerna:

Etin och propin har inte isomerer med tre positioneranslutning, de visas, börjar med butin. Pentin och dess homologer har isomerer av kolskelettet. Med avseende på trippelbindningen visas inte den rumsliga isomerismen hos acetylenkolväten.
De första fyra homologerna av etin är gaser som är dåligt lösliga i vatten. Acetylenkolväten C5 - C15 - vätskor. Fastämnen är etinhomologer med utgångspunkt från kolväte C17. Alkynes kemiska natur upplevertrippelbindningens betydande inflytande. Kolväten av denna typ är mer aktiva än eten, fäster olika partiklar. Den utbredda användningen av etin inom industri och teknik baseras på den här egenskapen. Vid avbränning av acetylen frigörs en stor mängd värme, som används vid skärning och svetsning av metaller.


























