
De enkleste organiske forbindelser er mættede og umættede kulbrinter. Disse inkluderer stoffer i klassen af alkaner, alkyner, alkener.

Deres formler inkluderer brint og carbonatomer i en bestemt sekvens og mængde. De findes ofte i naturen.
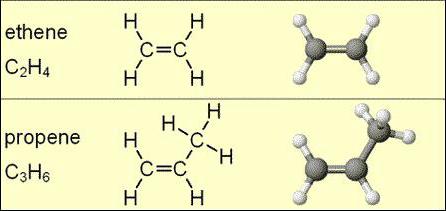
Deres andet navn er olefiner eller ethylen-carbonhydrider. Dette blev, hvad denne klasse af forbindelser blev kaldt i det 18. århundrede, da den olieagtige væske - ethylenchlorid - blev opdaget.
Alkener inkluderer stoffer bestående afbrint og kulstofelementer. De er klassificeret som acykliske kulbrinter. I deres molekyle er der en enkelt dobbelt (umættet) binding, der forbinder to carbonatomer til hinanden.
Hver klasse af forbindelser har sin egen kemiske betegnelse. I dem angiver symbolerne for elementerne i det periodiske system sammensætningen og strukturen af bindingen af hvert stof.

Den generelle formel for alkener er angivet som følger: CnX2N, hvor antallet n er større end eller lig med 2. Når man dechiffrer det, er det klart, at der for hvert carbonatom er to hydrogenatomer.
Molekylformler af homologe alkener er repræsenteret ved følgende strukturer: C2X4, C3X6, C4X8, C5X10, C6X12, C7X14, C8X16, C9X18, C10X20... Det kan ses, at hvert efterfølgende carbonhydrid indeholder endnu et carbon og 2 mere hydrogen.
Der er en grafisk betegnelse for placering og rækkefølge af kemiske forbindelser mellem atomer i et molekyle, der viser den strukturelle formel for alkener. Ved hjælp af valensstreg angives bindingen af kulhydrater med hydrogener.
Alkenes strukturformel kan afbildesi udvidet form, når alle kemiske elementer og bindinger vises. Det mere kortfattede udtryk for olefiner viser ikke forbindelsen af kulstof og brint under anvendelse af valensstråler.
Skeletformlen angiver den enkleste struktur. Den brudte linje repræsenterer molekylets base, hvor carbonatomerne er repræsenteret af dets toppe og ender, og forbindelserne angiver brint.
Baseret på den systematiske nomenklatur, formlenalkener og deres navne er sammensat af strukturen af alkaner relateret til mættede kulbrinter. For at gøre dette i sidstnævnte navn erstattes suffikset -an med -ilen eller -en. Et eksempel er dannelsen af butylen fra butan og penten fra pentan.
For at angive placeringen af en dobbeltbinding i forhold til kulstofatomer skal du angive et arabisk tal i slutningen af navnet.
Alkenes navn er baseret på notationendet længste carbonhydrid, hvor en dobbeltbinding er til stede. I begyndelsen af kædenummereringen vælges normalt den ende, der er tættest på den umættede forbindelse af carbonatomer.
Hvis den strukturelle formel for alkener hargrene, angiv derefter navnene på radikaler og deres antal, og foran dem placeres numre svarende til stedet i kulstofkæden. Dette efterfølges af navnet på selve carbonhydridet. Tallene følges normalt af en bindestreg.
Der er umættede radikale grene. Deres navne kan være trivielle eller dannes i henhold til reglerne i den systematiske nomenklatur.
For eksempel betegnes HNC = CH- som ethenyl eller vinyl.
Molekylære formler af alkener kan ikke indikere isomerisme. Imidlertid er rumlig modifikation iboende for denne klasse stoffer, med undtagelse af ethylenmolekylet.
Isomerer af ethylenhydrocarboner kan være carbonskelet, umættet bindingsposition, mellemklasse eller rumlig.
Den generelle formel for alkener bestemmer mængdenkulstof- og hydrogenatomer i kæden, men det viser ikke tilstedeværelsen og placeringen af dobbeltbindingen. Et eksempel er cyclopropan som en interklasse-isomer af C3X6 (propylen). Andre typer isomerisme vises i C4X8 eller buten.
En anden position af umættet forbindelse observeres ibuten-1 eller buten-2, i det første tilfælde er dobbeltforbindelsen placeret nær det første carbonatom, og i det andet - i midten af kæden. Kulstofskeletisomerisme kan overvejes ved anvendelse af methylpropen (CH3-C (CH3) = CH2) og isobutylen ((CH3) 2C = CH2).
Rumlig modifikation er iboende i buten-2 itrans og cis position. I det første tilfælde er sidegrupper placeret over og under den vigtigste carbonkæde med en dobbeltbinding, i den anden isomer er substituenterne på den ene side.
Den generelle formel for alkener bestemmer den fysiske tilstand for alle repræsentanter for denne klasse. Startende med ethylen og slutter med butylen (fra C2 til C4), stoffer findes i luftform. Så farveløs eten har en sødlig lugt, lav opløselighed i vand, og dens molekylvægt er mindre end luftens.
I flydende form er carbonhydrider med det homologe interval fra C5 til C17... Startende med alken, der har 18 carbonatomer i hovedkæden, sker en overgang af den fysiske tilstand til en fast form.
Alle olefiner anses for at have dårlig opløselighed ivandmiljø, men godt i organiske opløsningsmidler, såsom benzen eller benzin. Deres molekylvægt er mindre end vandets. En stigning i carbonkæden fører til en stigning i temperaturindikatorer under smeltning og kogning af disse forbindelser.
Den strukturelle formel for alkener viser tilstedeværelsen iskeletet af en dobbeltbinding af π- og σ- forbindelser med to carbonatomer. Denne struktur af molekylet bestemmer dets kemiske egenskaber. Π-bindingen betragtes som ikke særlig stærk, hvilket gør det muligt at ødelægge den med dannelsen af to nye σ-bindinger, som opnås som et resultat af fastgørelsen af et par atomer. Umættede kulbrinter er elektroniske donorer. De deltager i elektrofile tilknytningsprocesser.

En vigtig kemisk egenskab for alle alkener eren halogeneringsproces med frigivelse af forbindelser som dihalogenerede stoffer. Halogenatomer er i stand til dobbeltbinding til carbonatomer. Et eksempel er bromering af propylen til dannelse af 1,2-dibrompropan:
X2C = CH - CH3 + Br2 → BrCH2–CHBr - CH3.
Denne proces med neutralisering af farve i bromvand med alkener betragtes som et kvalitativt bevis for tilstedeværelsen af en dobbeltbinding.
Vigtige reaktioner inkluderer hydrogenering af olifinermed tilsætning af et hydrogenmolekyle under påvirkning af katalytiske metaller, såsom platin, palladium eller nikkel. Resultatet er kulbrinter med en mættet binding. Formler af alkaner, alkener er angivet nedenfor i hydrogeneringen af buten:
B3–CH2–CH = CH2 + H2 Ni→ CH3–CH2–CH2–CH3.
Processen med at binde et hydrogenhalogenidmolekyle til olefiner kaldes
hydrohalogenering, der passerer i henhold til reglen,opdaget af Markovnikov. Et eksempel er hydrobromering af propylen til dannelse af 2-brompropan. I det kombineres brint med en dobbeltbinding med kulstof, der betragtes som den mest hydrogenerede:
B3–CH = CH2 + HBr → CH3–BrCH - CH3.
Reaktionen ved tilsætning af vand med alkener under indvirkning af syrer kaldes hydrering. Resultatet er et propanol-2-alkoholmolekyle:
B3–HC = CH2 + H2O → CH3–OHCH - CH3.
Når alkener udsættes for svovlsyre, opstår sulfoneringsprocessen:
B3–HC = CH2 + HO - OSO - OH → CH3–CH3CH - O - SO2Åh.
Reaktionen finder sted med dannelsen af sure estere, f.eks. Isopropylsvovlsyre.
Alkener udsættes for oxidation under forbrændingen under iltets virkning med dannelsen af vand og kuldioxidgas:
2CH3–HC = CH2 + 9O2 → 6CO2 + 6H2O.
Interaktionen mellem olefiniske forbindelser ogfortyndet kaliumpermanganat i form af en opløsning fører til dannelsen af glycoler eller diatomiske alkoholer. Denne reaktion er også oxidativ med dannelsen af ethylenglycol og misfarvning af opløsningen:
3H2C = CH2 + 4H2O + 2KMnO4 → 3OHCH - CHOH + 2MnO2 + 2KOH.
Alkenes-molekyler kan være involveret i polymerisationsprocessen med en fri radikal eller kation-anionisk mekanisme. I det første tilfælde opnås der under indflydelse af peroxider en polymer af polyethylentypen.
Ifølge den anden mekanisme fungerer syrer som kationiske katalysatorer, og organometalliske stoffer er anioniske med frigivelsen af en stereoselektiv polymer.
De kaldes også paraffiner eller begrænsendeacykliske kulbrinter. De har en lineær eller forgrenet struktur, som kun indeholder mættede enkle bindinger. Alle repræsentanter for den homologe serie i denne klasse har den generelle formel CnX2n + 2.
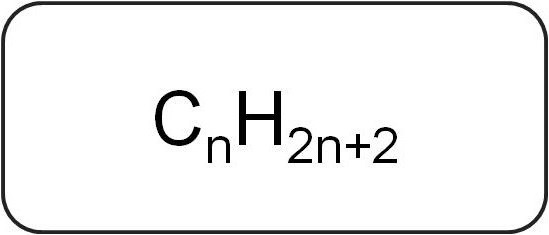
De indeholder kun kulstof og brintatomer. Den generelle formel for alkener er afledt af notationen af mættede carbonhydrider.
Den enkleste repræsentant for denne klasseer metan. Det efterfølges af stoffer som etan, propan og butan. Deres navn er baseret på roden af et tal på græsk, hvortil tilføjelsen -an tilføjes. Alkannavne er anført i IUPAC-nomenklaturen.
Den generelle formel for alkener, alkyner, alkaner inkludererkun to slags atomer. Disse inkluderer grundstofferne kulstof og brint. Antallet af kulstofatomer i alle tre klasser er det samme, forskellen observeres kun i antallet af brint, som kan opdeles eller fastgøres. Umættede forbindelser opnås fra mættede carbonhydrider. Repræsentanter for paraffiner i molekylet indeholder 2 flere hydrogenatomer end olefiner, hvilket er bekræftet med den generelle formel af alkaner, alkener. Alkenes struktur betragtes som umættet på grund af tilstedeværelsen af en dobbeltbinding.
Hvis vi relaterer antallet af brint- og kulstofatomer i alkaner, vil værdien være det maksimale i sammenligning med andre klasser af carbonhydrider.
Starter med metan og slutter med butan (fra C1 til C4), stoffer findes i luftform.
I flydende form er carbonhydrider med det homologe interval fra C5 til C16... Startende med en alkan, der har 17 carbonatomer i hovedkæden, sker en overgang af den fysiske tilstand til fast form.
De er kendetegnet ved isomerisme i kulstofskelettet og optiske modifikationer af molekylet.

I paraffiner betragtes kulstofvalenserfuldstændig optaget af nærliggende carbonatomer eller hydrogen til dannelse af en σ-type binding. Fra et kemisk synspunkt forårsager dette deres svage egenskaber, hvorfor alkaner kaldes mættede eller mættede kulbrinter, uden affinitet.
De indgår i substitutionsreaktioner forbundet med radikal halogenering, sulfochlorering eller nitrering af molekylet.
Paraffiner gennemgår oxidation, forbrænding eller nedbrydning ved høje temperaturer. Under virkningen af reaktionsacceleratorer elimineres hydrogenatomer, eller alkaner dehydreres.
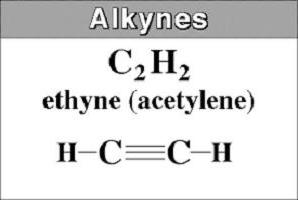
De kaldes også acetyleniske kulbrinter, som har en tredobbelt binding i carbonkæden. Strukturen af alkyner er beskrevet med den almene formel CnX2n - 2... Det viser, at i modsætning til alkaner mangler acetyleniske carbonhydrider fire hydrogenatomer. De erstattes af en tredobbelt binding dannet af to π-forbindelser.
Denne struktur bestemmer de kemiske egenskaber i denne klasse. Strukturformlen for alkener og alkyner viser tydeligt umættetheden af deres molekyler såvel som tilstedeværelsen af en dobbelt (H2C꞊CH2) og tredobbelte (HC≡CH) obligationer.
Den enkleste repræsentant er acetyleneller HC2CH. Det kaldes også etin. Det kommer fra navnet på et mættet carbonhydrid, hvor suffikset -an fjernes og -in tilføjes. I navnene på lange alkyner angiver nummeret placeringen af den tredobbelte binding.
At kende strukturen af mættet ogumættet er det muligt at bestemme under hvilket bogstav den generelle formel for alkyner er betegnet: a) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6. Den tredje mulighed er det rigtige svar.
Startende med acetylen og slutning med butan (fra C2 til C4), stoffer er af gasformig art.
I flydende form er der carbonhydrider med det homologe interval fra C5 til C17... Startende med alkyn, der har 18 carbonatomer i hovedkæden, finder en overgang af den fysiske tilstand sted i fast form.
De er kendetegnet ved isomerisme i kulstofskelettet, i positionen for den tredobbelte binding såvel som interklassemodifikationer af molekylet.
Med hensyn til kemiske egenskaber ligner acetyleniske carbonhydrider alkener.
Hvis alkyner har en terminal tredobbelt binding, så er deudføre funktionen af en syre med dannelsen af alkynidsalte, for eksempel NaCNCNa. Tilstedeværelsen af to π-bindinger gør natriumacetyledinmolekylet til en stærk nukleofil, der træder i substitutionsreaktioner.
Acetylen gennemgår chlorering i nærværelse af kobberchlorid for at opnå dichloracetylen, kondensation under virkning af halogenalkiner med frigivelse af diacetylenmolekyler.
Alkiner er involveret i yderligere reaktionerelektrofil, hvis princip er grundlaget for halogenering, hydrohalogenering, hydrering og carbonylering. Sådanne processer er imidlertid svagere end for alkener med dobbeltbinding.
For acetyleniske carbonhydrider er nukleofile additionsreaktioner af alkoholen, den primære amin eller hydrogensulfidmolekylet mulige.


























