
De strukturelle egenskapene til acetylen påvirker dens egenskaper, produksjon og bruk. Symbolet for stoffets sammensetning er C2H2 - Dette er den enkleste og grove formelen.Acetylen dannes av to karbonatomer, mellom dem en trippelbinding mellom. Dens tilstedeværelse gjenspeiles i forskjellige typer formler og modeller av etinmolekylet, som gjør det mulig å forstå problemet med strukturens innflytelse på egenskapene til materie.
Alkyne hydrokarboner, eller acetylen, eracyklisk, umettet. Kjeden med karbonatomer er ikke lukket, den inneholder enkle og flere bindinger. Sammensetningen av alkyner reflekterer den konsoliderte formel CnX2N - 2. I molekylene av stoffer i denne klassen er til stedeett eller flere trippelbindinger. Acetylenforbindelser er umettede. Dette betyr at bare en valens karbon realiseres på grunn av hydrogen. De resterende tre bindinger brukes i samspill med andre karbonatomer.
Первый - и наиболее известный представитель alkyner - acetylen eller etin. Det trivielle navnet på stoffet kommer fra det latinske ordet "acetum" - "eddik" og det greske - "hyle" - "treet". Grunnleggeren av den homologe serien ble oppdaget i 1836 i kjemiske eksperimenter, senere ble stoffet syntetisert fra kull og hydrogen av E. Davy og M. Berthelot (1862). Ved vanlig temperatur og normalt atmosfæretrykk er acetylen i gassform. Det er en fargeløs gass, luktfri, sparsomt oppløselig i vann. Etin er lettere løselig i etanol og aceton.

Etin er det enkleste medlemmet i sin homologe serie, dens sammensetning og struktur gjenspeiler formlene:
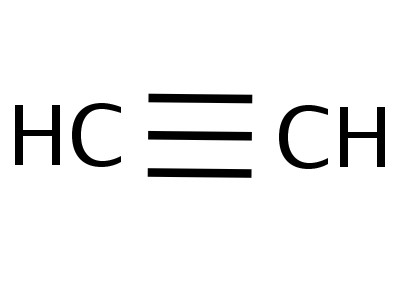
Formler som viser fordelingen av elektroner,fungerte som grunnlaget for opprettelsen av atombombemodeller, romlige formler av molekyler (stereokjemisk). Så langt tilbake på slutten av 1700-tallet ble kulestangmodeller utbredt - for eksempel baller i forskjellige farger og størrelser, som representerte karbon og hydrogen, som danner acetylen. Strukturformelen til molekylet presenteres i form av stenger som symboliserer kjemiske bindinger og deres mengde ved hvert atom.
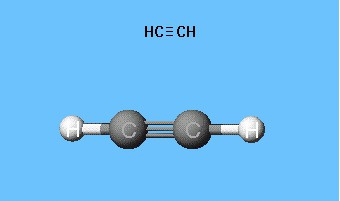
Den sfæriske stangmodellen av acetylen reproduserer180 ° valensvinkler, men internukleære avstander i molekylet reflekteres omtrent. Hulrommene mellom ballene skaper ikke ideen om å fylle rommet til atomer med elektrontetthet. Ulempen elimineres i Drading-modellene, som utpeker atomkjerner ikke med baller, men ved festepunktene for stengene til hverandre. Moderne volumetriske modeller gir en mer levende ide om atom- og molekylære orbitaler.
Karbon i opphisset tilstand inneholder tre p-orbitaler og en s med uparmerte elektroner. Ved dannelse av metan (CH4) de tar del i å skape likeverdbindinger med hydrogenatomer. Den berømte amerikanske forskeren L. Pauling utviklet doktrinen om hybridtilstanden til atomiske orbitaler (AO). Forklaringen på karbonens oppførsel i kjemiske reaksjoner er å samkjøre AO i form og energi, dannelsen av nye skyer. Hybrid orbitaler gir sterkere bindinger, formelen blir mer stabil.
Атомы углерода в молекуле ацетилена, в отличие от metan gjennomgår sp-hybridisering. I form og energi blir s- og p-elektroner blandet. To sp-orbitaler vises, liggende i en vinkel på 180 °, rettet mot motsatte sider av kjernen.

I acetylen, hybrid-elektron karbonskyerdelta i opprettelsen av σ-bindinger med de samme nabomater og med hydrogen i C - H-par. Det gjenstår to ikke-hybrid p-orbitaler vinkelrett på hverandre. I etinmolekylet deltar de i dannelsen av to π-bindinger. Sammen med σ oppstår det en trippelbinding som gjenspeiles i strukturformelen. Acetylen skiller seg fra etan og etylen i avstanden mellom atomer. Trippelbindingen er kortere enn den doble, men har en stor tilførsel av energi, er mer holdbar. Den maksimale tettheten av σ- og π-bindinger er lokalisert i vinkelrett regioner, noe som fører til dannelse av en sylindrisk elektronisk sky.
Etinmolekylet har en lineær form, som er vellykketreflekterer den kjemiske formelen til acetylen - H - C≡C - H. Karbon- og hydrogenatomene er plassert langs den samme rette linjen, det oppstår 3 σ og 2 π bindinger mellom dem. Fri bevegelse, rotasjon langs C - C aksen er umulig, dette forhindres ved tilstedeværelsen av flere bindinger. Andre funksjoner ved trippelbinding:
Til sammenligning: i etan og etylenmolekyler er lengden på en enkelt og dobbel kjemisk binding henholdsvis 1,54 og 1,34 nm, C - C brytende energi er 348 kJ / mol, C = C - 614 kJ / mol.

Acetylen er den enkleste representanten for alkyner, i molekylene som det også er en trippelbinding på. Propin CH3С≡СН - homolog av acetylen. Formelen til den tredje representanten for alkyner - butin-1 - CH3CH2С≡СН. Acetylen er det trivielle navnet på etin. Den systematiske nomenklaturen til alkyner adlyder IUPAC-reglene:

Etin og propin har ikke trippelposisjonsisomererforbindelse, vises de, starter med butin. Pentiner og påfølgende homologer har isomerer av karbonskjelettet. Med hensyn til trippelbinding vises ikke den romlige isomerismen til acetylen-hydrokarboner.
De første 4 homologene av etin er gasser som er dårlig løselig i vann. Acetylen hydrokarboner C5 - C15 - væsker. Faststoffer er etinhomologer som begynner med hydrokarbon C17. Alkynes kjemiske natur oppleverbetydelig innflytelse av trippelbinding. Hydrokarboner av denne typen er mer aktive enn etylen, og fester forskjellige partikler. Den utbredte bruken av etin i industri og teknologi er basert på denne egenskapen. Ved forbrenning av acetylen frigjøres en stor mengde varme som brukes til gassskjæring og sveising av metaller.


























