
Значение водородного показателя играет важную papel para muchas transformaciones químicas y biológicas que ocurren tanto en laboratorios como en producción, y en organismos vivos y el medio ambiente. La cantidad de iones de hidrógeno no solo afecta el resultado de cualquier reacción, sino también la posibilidad de que ocurra. Para mantener un valor de pH dado, se utilizan soluciones tampón. Su tarea es mantener este nivel al diluir soluciones o agregarles ácidos y álcalis.
El pH del agua es uno de los signos.calidad del agua para diversos fines. En la naturaleza, el desarrollo de las plantas, la agresividad del medio ambiente en estructuras metálicas y de hormigón, dependen de ello. Debe recordarse que el índice de hidrógeno cambia la toxicidad de los contaminantes para los organismos que viven en ríos, lagos, estanques.

Este parámetro caracteriza el contenido de iones Η+ en soluciones Se designa pH. Matemáticamente, el exponente de hidrógeno es igual al logaritmo decimal inverso de la concentración Η+ (CH +, mol / L): pΗ = −lgCH +. La cantidad de iones H + en el agua está determinada por la disociación de las moléculas de H2Acerca de ocurrir, de acuerdo con la expresión: N2Acerca de <–> N+ + OH-.
A pesar de que el agua no se acepta como electrolito, es una sustancia ligeramente disociante. Para ella, podemos escribir la constante de disociación: Kd= (CH +· COH-) / CH2O. En t = 22 ° C, su valor es 1.8ˑ10-16.
Esta cifra es tan pequeña que Η+ y OH- en agua podría ser descuidado. Pero en la química de las soluciones, el valor del índice de hidrógeno es aplicable para crear una escala de pH. Considera sus significados.
Con su ayuda, puede cuantificar la acidez de una solución.
| Valor P | 1 | 2 | 3 | 4 | 5 | 6 6 | 7 | 8 | yo | 10 | 11 | 12 | 13 14 |
| Calidad ambiental | agrio | neutral | alcalina |
El indicador de hidrógeno del medio es fácil de calcular. Solo necesita saber la concentración de cationes de hidrógeno y usar la fórmula: Cn + = 10Sr.donde n es el valor de pH opuesto. Por ejemplo, la concentración de H+ en solución es CH + = 10–5 mol / l. Es decir, n = –5 y pH = 5.

Todo en el entorno humano tiene su propiociertos valores de pH. Esto ayuda a varios sistemas del cuerpo a hacer frente más fácilmente a sus tareas. Como saben, para el agua neutra pura, el índice de hidrógeno es 7. Sin embargo, la piel humana tiene una reacción ligeramente ácida. Su pH = 5.5. En parte, este hecho afecta la apariencia de la piel seca con contacto frecuente con el agua. Los siguientes son indicadores de pH para algunas sustancias.
| Sustancia | pΗ |
| Electrolito de la batería | <1.0 |
| Jugo gástrico | 1,0-2,0 |
| Jugo de limon | 2,0 |
| Vinagre de mesa | 2,4 |
| Cola | 3,0 |
| Jugo de manzana | 3,0 |
| Cafe | 5,0 |
| El champú | 5,5 |
| Té negro | 5,5 |
| Piel humana | 5,5 |
| Lluvia ácida | <5.6 |
| Saliva | 6,5 |
| Leche | 6,7 |
| Agua | 7,0 |
| Sangre | 7,36 |
| Agua de mar | 8,0 |
| Jabón sólido | 9,5 |
| Lejía (lejía) | 12,5 |
Las soluciones acuosas, como ya se indicó anteriormente, puedentener una reacción neutral, ácida o alcalina del medio. El hecho de que la acidez de la solución se deba a la presencia de iones H +, y la alcalinidad debido a los iones OH- no significa que no contengan otros. En ambientes ácidos, es posible detectar un exceso de iones de hidrógeno, y en alcalinos, un exceso de iones de hidróxido.
En soluciones neutras, el exponente de hidrógeno es 7. Esto significa que la concentración de cationes N+ en ellos es igual a 10–7 mol / l, pero el contenido de aniones hidróxido también es 10–7 mol / l. En otras palabras, en soluciones neutras no hay exceso de Η + o ОΗ- iones.
¿Por qué el pH puede variar de 1 a 14? Para responder a esta pregunta, vale la pena volver a la expresión de la constante de disociación. Al convertirlo, podemos escribir Kd· CH2O= CH +· COH-. El valor de Cd es conocido, y la concentración de moléculas de agua se puede calcular fácilmente. Tratar el agua como una solución de H2Oh en n2Oh, puedes averiguar su concentración molar, formando la proporción: 18 g N2O - 1 mol, 1000 g de N2Oh x mol. Por lo tanto, x = 1000/18 = 55,6 mol / l. Esta constante se denota por Ken y llamado el producto iónico del agua.
Luego, multiplique el valor de Kd por el valor encontrado: 55,6 · 1,8ˑ10–16= CΗ +· CΗ–; 10–14 = CΗ +· CΗ–. Es decir, podemos escribir: Ken= CΗ +· CΗ– = 10–14.
Este valor nos permitió concluir que pΗ + pOΗ = 14, que es la respuesta a la pregunta anterior.
Todos los ácidos fuertes en el agua se disocian irreversiblemente. Entonces, el ácido clorhídrico se descompone completamente en cationes Η+ y aniones cloruro Cl-: ΗCl = Η++ Cl-. Si se agrega 1ˑ10 a 1 litro de agua-2 mol ΗCl, luego la concentración de iones Η+ también será igual a 1.10-2 mol. Es decir, para tal solución, el índice de hidrógeno es 2.
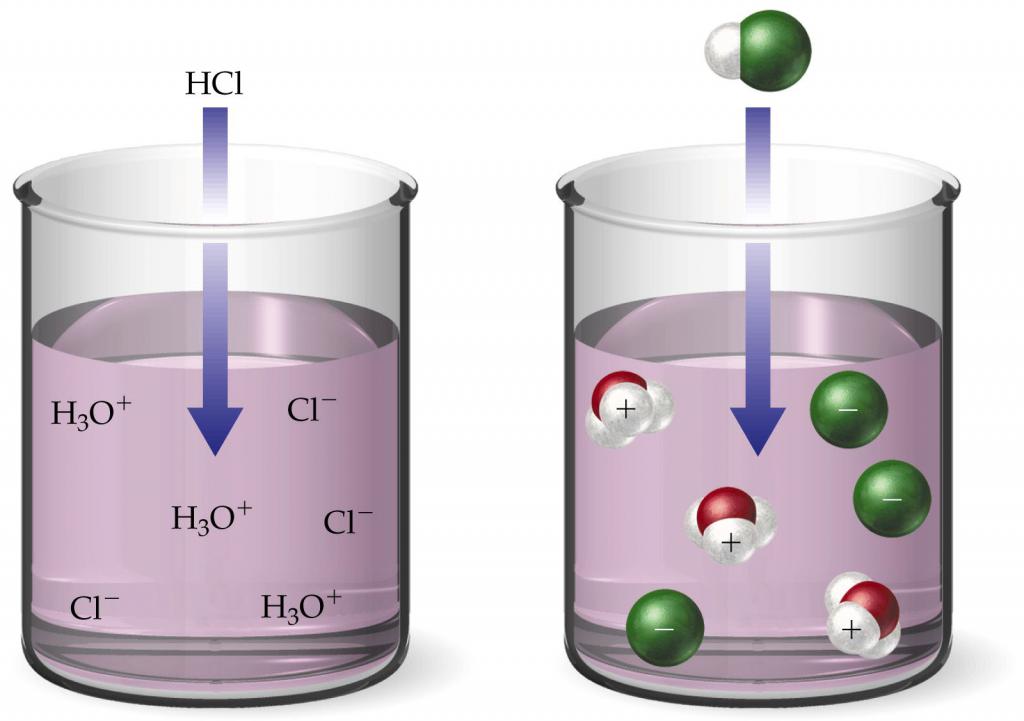
Los ácidos débiles se disocian reversiblemente, es decir,Como en el caso del agua, parte de los iones con carga opuesta se combinan nuevamente en moléculas de ácido. Por ejemplo, el ácido carbónico se descompone en los siguientes iones: Η2Con3 <–> Η++ ΗCO3-. No solo no todas las moléculas se disocian, sino que también se desintegran nuevamente formando un todo único. Por lo tanto, para encontrar el exponente ácido de hidrógeno de los ácidos, se usa la constante de disociación.
Además, la fuerza del ácido puede estimarse indirectamente por el pH de la solución: cuanto mayor es, menor es el valor de pΗ.
Cuando las bases se disuelven en agua, comienzandisociación con la aparición de aniones hidróxido. Interactúan con iones H +, que están presentes en agua limpia neutra. Esto conduce a una disminución en su concentración, es decir, a un aumento en el pH.
Por ejemplo: NaOΗ = Na++ OΗ-; Η++ OΗ-= Η2O.
En una solución de hidróxido de sodio con una concentración de 1ˑ10-2 mol / l aparece 1ˑ10-2 aniones de hidróxido mol / L. Concentración de cationes Η+ en tal solución será igual a 1ˑ10-12 mol / l, y pΗ tiene un valor de 12.
En todas las soluciones base, la cantidad de cationes N+ siempre menos de 1ˑ10-7 mol / l, y el índice de hidrógeno es mayor que 7.

Una de las formas más fáciles de aproximardetermine pΗ de la solución: use las tiras del indicador universal. Al comparar con la escala del indicador su color, que aparece después de sumergir en la solución de trabajo, es posible estimar la concentración de iones Η+. Un indicador universal es una mezcla de varias sustancias que cambia su color secuencialmente de rojo a violeta (como en un arco iris) con una disminución de la acidez.
Las principales desventajas de este método son la imposibilidad de determinar el índice de hidrógeno en soluciones coloreadas o turbias, así como solo una estimación aproximada de la concentración de iones Η+ en solución
Para una determinación aún más gruesa del pHAplicar varios indicadores. El tornasol más utilizado, metil naranja, fenolftaleína y otros. Al cambiar su color, solo puede averiguar si la composición de prueba es ácida, alcalina o neutra.
| Indicador | pΗ <7 | pΗ = 7 | p> 7 |
| Tornasol | rojo | morado | azul |
| Fenolftaleína | incoloro | incoloro | frambuesa |
| Naranja de metilo | rosa | naranja | amarillo |
Significativamente más precisa concentración de iones Η+, y por lo tanto pΗ de la solución, se puede encontrar conutilizando un medidor de pH. Este método de análisis se llama potenciométrico. Se basa en medir el potencial del electrodo y determinar la relación entre su valor y la concentración del componente en la solución de prueba. El potencial del electrodo surge debido al proceso electroquímico que se realiza en la interfaz metal-solución.

MedirUna célula galvánica de dos semicélulas con electrodos, cuyo potencial se conoce de antemano. Luego mida el EMF. Muy a menudo, la determinación del índice de hidrógeno en soluciones acuosas se lleva a cabo utilizando cloruro de plata y electrodos de vidrio. El primero de ellos es un electrodo de referencia. El valor del potencial del segundo depende de la concentración de iones Η+ en solución
Además, se determina el valor de pH en los laboratorios.colorimétrico Este método se basa en la capacidad de los indicadores de dos colores para cambiar su color o intensidad de color, dependiendo del contenido de cationes de hidrógeno. El color que aparece en la solución se compara con una escala estándar, que se basa en datos de soluciones con un valor de pH conocido.
Son los siguientes:
1. Para la producción de productos con las propiedades deseadas. Durante el proceso de fabricación, desviación deEl pH tecnológico puede causar alteraciones que conducen a un cambio en las características del producto. Dichos indicadores pueden ser el sabor o la apariencia.
2. Para reducir el costo. En algunas industrias, el rendimiento del producto depende directa o indirectamente del pH del medio de reacción. En consecuencia, cuanto mayor es el rendimiento del producto de reacción, menor es su costo.
3. Para proteger la mano de obra o el medio ambiente. Dado que muchos compuestos exhiben sus propiedades dañinas solo a un cierto pH, es muy importante controlar su valor.
4. Para cumplir con los estándares del producto. En muchos documentos reglamentarios que estandarizanLa calidad del producto, producto, medicamento, etc., hay una lista de indicadores que deben cumplir. Uno de ellos es el pH. Por lo tanto, su definición en cierta medida ayuda a proteger a la población de las sustancias nocivas.
5. Para proteger el equipo. La mayoría de los equipos de producción,que está en contacto con productos químicos es susceptible a la corrosión. La velocidad de su desarrollo depende mucho de los valores de pH. En otras palabras, la medición del pH es importante para proteger el equipo de producción de daños innecesarios.

6. Para fines de investigación. El nivel de pH es importante para estudiar diversos procesos bioquímicos. También se mide con fines médicos para confirmar un diagnóstico particular.
Para una determinación calculada del pH de la solución, datos sobre la concentración molar de cationes Η+ o ОΗ-anión Si se conocen, puede usar inmediatamente una de las fórmulas:
La concentración de un ion particular en mol / l en una solución de electrolitos es fácil de encontrar mediante la ecuación:
Cm ion = CmˑΑˑ⋅n, donde:
Cm ion y Cm - concentraciones molares de iones y electrolitos, respectivamente (mol / L).
α es el grado de disociación.
n es el número de iones de la especie en cuestión, que se forma durante la descomposición de una sola molécula de electrolito.
El grado de disociación de electrolitos débiles puede determinarse mediante la ley de dilución de Ostwald: α = √ (Kd/ Sm)
1. Se requiere calcular el pH de una solución de NaOH 0.001 N.
Solución: dado que el hidróxido de sodio es un electrolito fuerte, su disociación en una solución acuosa es irreversible. Va de acuerdo con la ecuación: NaOΗ → Na + OΗ.
Usamos la fórmula Cm ion = CmˑΑˑn. Suponemos que el grado de disociación es igual a 1. Cuando se destruye una molécula de NaOH, se forma un ion OH-, lo que significa n = 1. Conm por la condición del problema, se conoce y es igual a 0.001 o 10-3. De aquí aOH= 10-3ˑ1ˑ1 = 10-3.
La concentración de iones Η + puede determinarse a partir de la relación Ken= CΗ +· CΗ– = 10–14. Transformando la fórmula, obtenemos CH += Ken/ SΗ–= 10–14/ 10-3= 10–11. A continuación, podemos calcular el índice de hidrógeno: pΗ = -lg10-11= 11.
Respuesta: pH = 11.

2. Se requiere calcular [Η+] y [OH-], si está en una solución dada pH = 4.3.
Solución: Es más fácil encontrar primero la concentración de cationes de hidrógeno: [Η+u = 10-rΗ = 10-4,3 = 5ˑ10-5 mol / l.
La concentración de aniones hidróxido se encuentra convenientemente a partir de la proporción del producto iónico del agua: COΗ-= Ken/ SΗ += 10–14/ 5ˑ10-5= 2ˑ10–10 mol / l.
Respuesta: 5ˑ10-5 mol / ly 2ˑ10–10 mol / l.


























